题目内容
【题目】已知:①CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+![]() O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+![]() O2(g)===H2O(l) ΔH4=-d kJ·mol-1
O2(g)===H2O(l) ΔH4=-d kJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知ΔH3>ΔH4
B. H2的燃烧热为c kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
【答案】A
【解析】
根据盖斯定律计算反应热,根据燃烧热的概念分析解答。
A. ③ 中产物水为气态,④中产物水为液态,水由液态变为气态需要吸收热量,所以③中放出的热量小于④中放出的热量,即ΔH3>ΔH4,故A正确;
B. 燃烧热应该是1mol的可燃物完全燃烧产生稳定的氧化物所放出的热量,水的稳定状态是液体,而c kJ·mol-1是生成气态水时的反应热,故B错误;
C. 由盖斯定律得:CH3OH(g)===CO(g)+2H2(g)由热化学方程式①-②-2③而来,所以ΔH=( -a+b+2c)kJ·mol-1,故C错误;
D. 由热化学方程式②和④知,当CO和H2的物质的量分别为1mol和2mol时,其完全燃烧生成CO2和H2O(l)时,放出的热量为b+2d kJ,若放出Q kJ热量,则混合气中CO的物质的量为![]() mol,故D错误。
mol,故D错误。
故选A。

 名校课堂系列答案
名校课堂系列答案【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
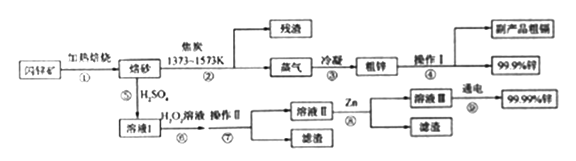
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
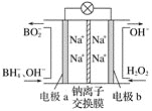
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。