题目内容
9.碱式碳酸锌 xZnCO3•yZn(OH)2•zH2O主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O、CuO+2H+=Cu2++H2O(写其中任意两个).
(2)从滤渣I中分离出S1O2的部分流程如下:滤渣1$→_{过滤}^{试剂X}$溶液$→_{过滤}^{通入足量CO_{2}}$沉淀$\stackrel{操作1}{→}$SiO2
①试剂X的名称为氢氧化钠.
②操作1的方法为灼烧.
(3)加入锌粉的目的是除去溶液中的Fe2+、Cu2+,从滤渣Ⅱ中获取铜的操作方法为向滤渣2中加入过量的稀硫酸(或稀盐酸),充分反应后过滤.
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO20.224L,则该碱式碳酸锌的化学式为Zn3(OH)4CO3•H2O或ZnCO3•2Zn(OH)2•H2O.
分析 利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程:锌焙砂含有少量氧化铜和氧化铁等杂质.加入稀硫酸溶解过滤,ZnO+H2SO4=ZnSO4+H2O,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O,滤渣Ⅰ为二氧化硅、不溶性杂质,得到溶液中含有硫酸锌、硫酸铜、硫酸铁,在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉锌将三价铁离子还原成亚铁离子,锌置换出铁和铜,滤渣2为Zn、Fe、Cu,过滤得到溶液中加入碳酸钠过滤得到碱式碳酸锌.
(1)二氧化硅不与硫酸反应,氧化锌、氧化铁、氧化铜分别与酸反应生成相应的离子;
(2)二氧化硅和氢氧化钠反应生成硅酸钠和水,通入二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸沉淀,灼烧分解生成二氧化硅;
(3)在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉置换出铁和铜,锌、铁能和硫酸反应,而铜不能,加硫酸从滤渣Ⅱ中获取铜;
(4)碱式碳酸锌分解生成氧化锌,二氧化碳和水,结合元素守恒计算化学式.
解答 解:(1)锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)加入稀硫酸溶解:ZnO+H2SO4=ZnSO4+H2O,离子反应为:ZnO+2H+=Zn2++H2O,
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子反应为:Fe2O3+6H+=2Fe3++3H2O,CuO+H2SO4=CuSO4+H2O,离子反应为:CuO+2H+=Cu2++H2O,二氧化硅不与硫酸反应,
故答案为:ZnO+2H+=Zn2++H2O;Fe2O3+6H+=2Fe3++3H2O(CuO+2H+=Cu2++H2O);
(2)滤渣Ⅰ为二氧化硅、不溶性杂质,二氧化硅与氢氧化钠反应生成可溶性的硅酸钠和水,所以加入氢氧化钠,其反应化学方程式为SiO2+2NaOH═Na2SiO3+H2O,通入二氧化碳,二氧化碳和硅酸钠溶液反应CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,生成硅酸沉淀,灼烧分解生成二氧化硅:H2SiO3$\frac{\underline{\;高温\;}}{\;}$SiO2+H2O,
故答案为:①氢氧化钠;②灼烧;
(3)加入过量锌粉锌将三价铁离子还原成亚铁离子3Zn+2Fe3+=3Zn2++2Fe2+,在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉置换出铁和铜,锌、铁能和硫酸(或盐酸)反应,而铜不能,加硫酸(或盐酸)从滤渣Ⅱ中获取铜,
故答案为:除去溶液中的Fe2+、Cu2+;向滤渣2中加入过量的稀硫酸(或稀盐酸),充分反应后过滤;
(4)碱式碳酸锌分解生成氧化锌,二氧化碳和水,结合元素守恒计算化学式;加碳酸铵时生成的沉淀是碱式碳酸锌,取该碱式碳酸锌3.41g,在400~500℃下加热至质量不再变化,得到氧化锌2.43g物质的量=$\frac{2.43g}{81g/mol}$=0.03mol,标准状况下的CO2 0.224L,物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol
水的物质的量=$\frac{3.41g-2.43g-0.01mol×44g/mol}{18g/mol}$=0.03mol
氧元素物质的量=$\frac{3.41g-0.03mol×65g/mol-0.01mol×12g/mol-0.06mol×1g/mol}{16g/mol}$=0.08mol
n(Zn):n(C):n(H):n(O)=0.03:0.01:0.06:0.08=3:1:6:8,碱式盐为Zn3(OH)4CO3•H2O或ZnCO3•2Zn(OH)2•H2O,
故答案为:Zn3(OH)4CO3•H2O或ZnCO3•2Zn(OH)2•H2O.
点评 本题考查了物质分离提纯的实验方法和过程分析判断,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题干信息的分析理解,操作步骤的注意问题和基本操作方法,(4)碱式碳酸锌的化学式的计算是解题关键,题目难度中等.

| A. | 苏打 | B. | 小苏打 | C. | 氢氧化钠溶液 | D. | 石蕊溶液 |
请回答下列问题:
| 物质的量 时间 | n(X)/mol | n(Y)/mol | n(M)/mol | n(N)/mol |
| 0 | 2.0 | 1.0 | 1.0 | 1.0 |
| 10min | 1.0 | 2.0 | 3.0 | 4.0 |
| 20min | 0.5 | 2.5 | 4.0 | 5.5 |
| 30min | 0.25 | 2.75 | 4.5 | 6.25 |
(2)列式计算N在0~10min内平均反应速率为0.15mol/(L•min);
(3)随着反应进行,容器内气体密度将不变;混合气体平均相对分子质量将减小.(填“增大”“减小”或“不变”)
(4)其他条件不变,若起始向容器中投入4molX(g),消耗一半X时所用时间t<(填“>”“<”或“=”)10min,理由是压强增大,反应速率增大.
(5)向容器中通入惰性气体,下列推断正确的是C.
A.反应速率增大 B.反应速率减小 C.反应速率不变 D.无法判断
(6)按上述反应规律,进行到40min时M为4.75mol.
| A. | 1mol H2SO4的质量就是1个H2SO4分子的质量的98倍 | |
| B. | 水的摩尔质量是18g | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 24g O2分子与24g O3分子所含的氧原子数相等 |
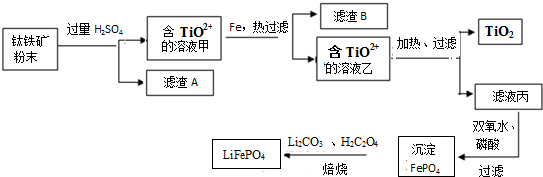
已知:FeTiO3+4H+=Fe2++TiO2++2H2O草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为SiO2(填化学式).
(3)含TiO2+溶液乙转化生成TiO2的离子方程式是TiO2-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+.
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%(用代数式表示).
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,由TiCl4→Ti需要在Ar气中进行的理由是高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用.反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于1412℃即可.
| A. | N P Cl | B. | P O S | C. | N O S | D. | O P Cl |
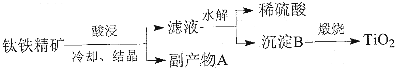
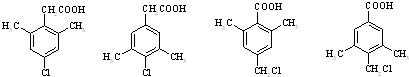 任意一种(任写一种).
任意一种(任写一种).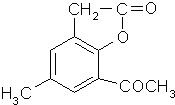 .
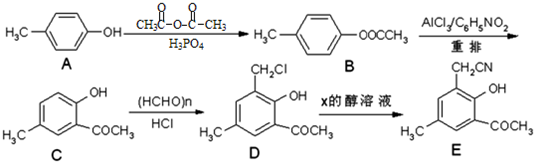
.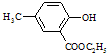 的合成路线流程图.
的合成路线流程图.