题目内容
14.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、SiO2等杂质.利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图: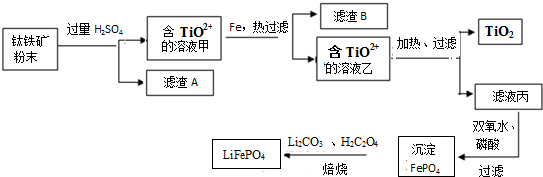
已知:FeTiO3+4H+=Fe2++TiO2++2H2O草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为SiO2(填化学式).
(3)含TiO2+溶液乙转化生成TiO2的离子方程式是TiO2-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+.
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%(用代数式表示).
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,由TiCl4→Ti需要在Ar气中进行的理由是高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用.反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于1412℃即可.
分析 (1)根据化合价代数和为0判断铁的化合价;
(2)铁矿石加入过量硫酸溶解,二氧化硅不溶于酸,所以过滤得到滤渣为二氧化硅;
(3)TiO2+在加热条件下水解可以转化成TiO2;
(4)滤液丙与双氧水反应,将亚铁离子氧化成铁离子,得沉淀磷酸铁,磷酸铁再被草酸还原成亚铁离子,根据电子得失守恒可计算双氧水与H2C2O4的质量比;
(5)根据电子守恒和元素守恒,有关系式TiO2~NH4Fe(SO4)2,根据NH4Fe(SO4)2的体积和浓度可计算得TiO2的物质的量,根据$\frac{TiO2质量}{样品质量}$×100%计算TiO2质量分数;
(6)用镁还原TiCl4得Ti,根据元素守恒写化学方程式,高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用,所以不能与空气接触,采用真空蒸馏时,要使其它成份变成蒸气,而Ti不能汽化,结合题中给出的各物质沸点判断温度.
解答 解:(1)根据化合价代数和为0规则可知,化合物FeTiO3中铁元素的化合价是+2价,故答案为:+2;
(2)铁矿石加入过量硫酸溶解,二氧化硅不溶于酸,所以过滤得到滤渣为二氧化硅,故答案为:SiO2;
(3)TiO2+在加热条件下水解可以转化成TiO2,反应离子的方程式为TiO2-+H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+,故答案为:TiO2-+H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+;
(4)滤液丙与双氧水反应,将亚铁离子氧化成铁离子,得沉淀磷酸铁,磷酸铁再被草酸还原成亚铁离子,根据电子得失守恒有关系式H2C2O4~2FePO4~H2O2,所以17%双氧水与H2C2O4的质量比为$\frac{34}{17%}$:90=20:9,
故答案为:20:9;
(5)根据电子守恒和元素守恒,有关系式TiO2~NH4Fe(SO4)2,所以TiO2的物质的量为cV×10-3mol,所以TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%,
故答案为:$\frac{cV×10{\;}^{-3}×M}{w}$×100%;
(6)用镁还原TiCl4得Ti,反应的化学方程式为TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用,所以反应需要在Ar气中进行,采用真空蒸馏时,要使其它成份变成蒸气,而Ti不能汽化,结合题中给出的各物质沸点可知,需加热的温度略高于1412℃即可,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti;高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用;1412.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,考查了化合价判断、离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 2:3 |
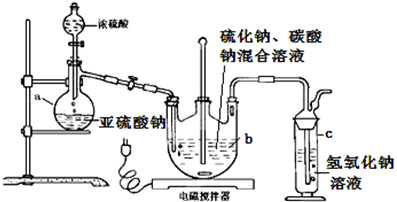
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动.
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体.
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜.
④冷却结晶、抽滤、洗涤.
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量.
请回答以下问题:
(1)仪器b的名称是三颈烧瓶;
(2)步骤②中若控制PH值小于7,则产率会下降,请用离子方程式解释原因:S2O32-+2H+=S↓+H2O+SO2↑.
(3)步骤③中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠脱水并分解;晶膜通常在溶液表面出现的原因是因为溶液表面温度较低.
(4)步骤④中洗涤硫代硫酸钠晶体试剂的结构式是
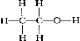 .
.(5)下列有关抽滤的说法中,正确的是A B D.
A.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量洗涤液于试管中进行相关实验
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时俯视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
E.滴定时震荡锥形瓶较剧烈.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaHCO3调节体系的pH在4.4≤pH<7.5范围内.
(3)反应Ⅲ中生成的气体空气变红棕色,则反应3中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的pH.若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
| A. | 离子化合物 | B. | 电解质 | C. | 钠盐 | D. | 碱性氧化物 |
| 品名 | ***蔬菜苏打饼*** |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、 脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2008 年1月20日 |
| A. | 富含蛋白质的是鲜鸡蛋 | B. | 富含淀粉的是面粉和白砂糖 | ||
| C. | 富含油脂的是精炼食用植物油 | D. | 富含维生素的是脱水青菜和橙汁 |

 氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:
氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤: