题目内容
【题目】甲苯是一种重要的化工原料,能用于生产苯甲醛、苯甲酸等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 溶点(℃) | 沸点(℃) | 相对密度( | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易热易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛,苯甲酸三者互溶;
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈烧瓶中加入0.5g固态难溶性催化剂, 再加入15mL冰醋酸和2mL甲苯,搅拌升温至7O℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a主要作用是_____________。三颈烧瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯笨甲醛的产量却有所减少,可能的原因是_____________。
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、______(填坡操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_____(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定。可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.OOmL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液vmL。产品中苯甲酸的质量分数为______(列出原始的计算式,不需要化简)。
③下列情况会使测定结果偏低的是_______(填字母)。
a.滴定终点时俯视读取耗喊量 b.KOH标准液长时间接触空气
c.配且KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液
【答案】 冷凝回流 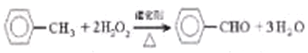 H2O2在较高温度时分解速度加快,使实际参加反应H2O2的减少,影响产量 过滤 蒸馏 dacb
H2O2在较高温度时分解速度加快,使实际参加反应H2O2的减少,影响产量 过滤 蒸馏 dacb 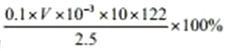 ab
ab
【解析】(1)仪器a具有球形特征的冷凝管,名称为为球形冷凝管,甲苯挥发会导致产率降低,冷凝回流,防止甲苯挥发导致产率降低;三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水,反应方程式为:![]() ;
;
(2)但温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,苯甲醛的产量却有所减少;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸;
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸,再洗涤、干燥得到苯甲酸,故正确的操作步骤是:dacb;
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.2g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液VmL,苯甲酸的物质的量等于消耗KOH物质的量,则2.500g产品中苯甲酸为0.001VL×0.1mol/L×![]() ×122g/molg,产品中苯甲酸的质量分数为
×122g/molg,产品中苯甲酸的质量分数为![]() ;
;
③a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小,计算苯甲酸的质量偏小,测定结果偏低,故a符合;b.KOH标准液长时间接触空气,会吸收二氧化碳步骤转化为碳酸钾,导致消耗氢氧化钾溶液体积偏大,测定结果偏高,故b不符合;c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大,测定结果偏高,故c不符合;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小,测定结果偏低,故d符合,故答案为ad。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】下述实验能到达预期目的的是
选项 | 实验内容 | 实验目的 |
A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH) 3胶体 |
D | 往混有FeCl2的CuCl2溶液中加人H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
A. A B. B C. C D. D
【题目】锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如下(部分条件未给出)。

(1)FeTiO3中Ti的化合价为______;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂的物质的量之比为__________。
(2)FeSO4溶解度与温度关系如下表,
温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
FeSO4 (g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
则操作I 的名称为_______、过滤。
(3)“转化” 步骤中对溶液进行加热的主要目的是_____________。
(4)写出“沉铁”的离子反应方程式___________,为使Fe3+完全沉降,则PO43-的浓度至少应为___________(己知:Ksp (FePO4· 2H2O) = 9.91×10-16)。
(5)流程中可循环利用的物质是(H2O除外)______,写出固相焙烧的反应方程式______。
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的
反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式______________。
【题目】工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂的废气SO2,并制备
MnSO4·H2O晶体,其工艺流程如下:

已知:①浸出液的pH<2,其中的金属阳离子主要是Mn2+,还有少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
请回答下列问题:
(1)加入MnO2氧化时溶液中反应的离子方程式为_______________________________。
(2) 若流程中取消“加入MnO2”,对上述流程的影响是____________________________。
(3)试剂X能否选用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2],判断并说明理由: ________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是___________________。
(5)从滤液中提取MnSO4·H2O晶体的操作是___________________。