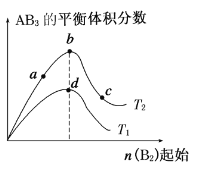
题目内容
【题目】某同学用下列装置制备并检验Cl2的性质。
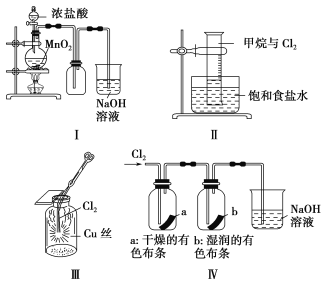
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【答案】D
【解析】
试题分析:A.浓盐酸与二氧化锰的反应过程中浓度逐渐降低,稀盐酸与二氧化锰不反应,所以Ⅰ图中:如果MnO2过量,浓盐酸也不可能全部被消耗,A错误;B.Ⅱ图中:量筒中发生了甲烷和氯气的取代反应,B错误; C.Ⅲ图中铜和氯气反应生成氯化铜,产生棕黄色烟,C错误;D.氯气与水反应生成的次氯酸具有漂白性,因此Ⅳ图中湿润的有色布条能褪色。氯气与氢氧化钠反应生成次氯酸钠、氯化钠和水,加入硫酸后次氯酸钠氧化氯离子生成氯气,D正确,答案选D。

练习册系列答案
相关题目
【题目】某温度下,反应:H2(g) + CO2(g)![]() H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 |
c(H2)/mol L-1 | 0.010 | 0.020 |
C(CO2)/mol·L-1 | 0.010 | 0.010 |
下列判断正确的是
A. 平衡时,甲容器中H2的转化率为60%
B. 平衡时,乙容器中H2的转化率大于60%
C. 平衡时,乙容器中c(H2)是甲容器中的2倍
D. 反应开始时,甲容器中的反应速率比乙容器中的反应速率快