题目内容
17.已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=akJ/mol
②2H2(g)+O2(g)═2H2O(g)△H2=bkJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H3=ckJ/mol
④2H2(g)+O2(g)═2H2O(1)△H4=dkJ/mol.
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
分析 燃烧反应为放热反应,则△H均小于0,物质的聚集状态不同,反应放出的热量不同,热化学反应方程式中物质的量与反应放出的热量成正比,以此来解答.
解答 解:A、对于放热反应,当反应物能量相同时,生成物的能量越低,反应放出的热量越多,△H越小,而①和③相比,③中水为液态,能量低于气态水,故反应③放出的热量大于①,即c<a<0,故A错误;
B、由于燃烧均为放热反应,故△H均小于0,且对于放热反应,当反应物能量相同时,生成物的能量越低,反应放出的热量越多,△H越小,而④和②相比,④中水为液态,能量低于气态水,故反应④放出的热量大于②,即d<b<0,故B 错误;
C、由于燃烧均为放热反应,故△H均小于0,且由于反应②是①的2倍,故b是a的2倍,故有2a=b<0,故C正确;
D、由于燃烧均为放热反应,故△H均小于0,故D错误.
故选C.
点评 本题考查了反应热的大小比较,应注意的是反应热的比较要带着正负号比较,且反应热的大小与物质的状态和反应的计量数有关,难度不大.

练习册系列答案
相关题目
8.能正确表示下列反应的离子方程式是( )
| A. | Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | H2SO4与Ba(OH)2反应:Ba2++SO42-═BaSO4 | |
| C. | 铁溶于足量的稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
5.实验室制取氯气的方法与下列哪种气体的制取方法相同( )
| A. | 制取氢气 | B. | 制取氧气 | C. | 制取氯化氢 | D. | 制取二氧化碳 |
12.已知:
①CaO(s)+H2O(1)═Ca(OH)2(aq);△H1
②CaO(s)+2HCl(g)═CaCl2(s)+H2O(1);△H2
③NH3(g)+HCl(g)═NH4Cl(s);△H3
④Ca(OH)2(aq)+2NH4Cl(s)═CaCl2(aq)+2NH3(g)+2H2O(1);△H4>0
下列关于上述反应焓变的判断正确的是( )
①CaO(s)+H2O(1)═Ca(OH)2(aq);△H1
②CaO(s)+2HCl(g)═CaCl2(s)+H2O(1);△H2
③NH3(g)+HCl(g)═NH4Cl(s);△H3
④Ca(OH)2(aq)+2NH4Cl(s)═CaCl2(aq)+2NH3(g)+2H2O(1);△H4>0
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0 | B. | △H4=△H1-△H2-2△H3 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
2.要除去氯化钠溶液中含有的少量碳酸钠,可采用的方法是( )
| A. | 通入适量的CO2 | B. | 加入过量的BaCl2溶液 | ||
| C. | 加入适量的稀盐酸 | D. | 加入过量的稀硝酸 |
2.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入过量的10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.得到表1的数据:
表1
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为还应该增加一个实验,并补做如下实验:10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
D.利用上述实验数据即可计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的△H
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}×100%$(用代数式表示).
附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入过量的10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.得到表1的数据:
表1
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为还应该增加一个实验,并补做如下实验:10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
D.利用上述实验数据即可计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的△H
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}×100%$(用代数式表示).
附表:溶解度表
| 溶解度 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
20.相同状况下,下列气体占有的体积最大的是( )
| A. | 64g SO2 | B. | 16g O2 | C. | 34g H2S | D. | 3g H2 |
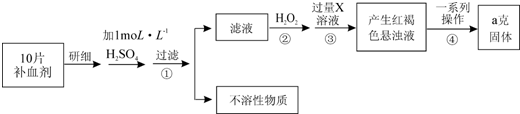
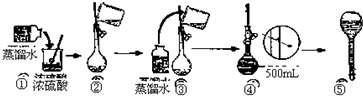
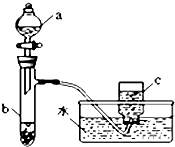 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.