题目内容
19.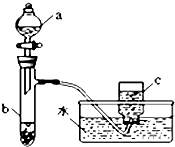 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.(1)甲组同学采用如图所示装置验证铜与硝酸的反应.已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜.
①仪器c中收集的气体主要是NO(填化学式).
②请写出铜与稀硝酸反应的离子反应方程式3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑.
③在铜与硝酸的反应中,硝酸所表现出的化学性质主要有酸性和强氧化性.
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是9.8 g.
(2)乙组同学对铁与稀硝酸的反应进行探究.他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+.则
①反应结束后的溶液中NO3- 的物质的量 n 的取值范围是2a<n(NO3-)<3a(用含a的代数式等表示).
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)为1:1,则b:a的值为10:3.
分析 (1)①进入仪器c的气体为NO2,NO2与水反应生成NO;
②铜与稀硝酸反应生成硝酸铜、一氧化氮、水,据此书写;
③反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物;
④铜完全反应生成硝酸铜,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据n=$\frac{m}{M}$计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
(2)①利用极限法分析解答,全部为Fe3+时,溶液中NO3-的物质的量最大,全部为Fe2+时,溶液中NO3-的物质的量最小,据此解答;
②用a表示出溶液中Fe3+、Fe2+的物质的量,进而用a表示出溶液中NO3-的物质的量,根据氮原子守恒用a、b表示出NO的物质的量,根据电子转移守恒解答.
解答 解:(1)①进入仪器c的气体为NO2,NO2与水反应生成NO,仪器c中收集的气体主要是NO,故答案为:NO;
②铜与稀硝酸反应生成硝酸铜、一氧化氮、水,反应离子方程式为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
③反应中N元素的化合价部分未变化生成硝酸铜,硝酸表现酸,性部分降低生成氮的氧化物,硝酸表现强氧化性,
故答案为:酸性和强氧化性;
④3.2g铜的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.1mol,故m[Cu(OH)2]=0.1mol×98g/mol=9.8g,故答案为:9.8;
(2)①全部为Fe3+时,溶液中NO3-的物质的量最大,故NO3-的物质的量最大为3amol,全部为Fe2+时,溶液中NO3-的物质的量最小,故NO3-的物质的量最小为3amol,由于溶液中含有Fe3+和Fe2+,故2amol<n(NO3-)<3amol,
故答案为:2amol<n(NO3-)<3amol;
②n(Fe3+):n(Fe2+)=1:1,则n(Fe3+)=$\frac{1}{2}$amol、n(Fe2+)=$\frac{1}{2}$amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)=$\frac{1}{2}$amol×3+$\frac{1}{2}$amol×2=$\frac{5a}{2}$mol,由氮原子守恒可知,n(NO)=bmol-$\frac{5a}{2}$mol,根据电子转移守恒有:$\frac{1}{2}$amol×3+$\frac{1}{2}$amol×2=(b-$\frac{5a}{2}$)mol×(5-2),整理得b:a=$\frac{10}{3}$,
故答案为:10:3.
点评 本题考查硝酸的化学性质、化学计算等,难度中等,注意利用守恒思想与极限法的进行的计算.

| A. | Cl2通入NaOH溶液中 Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 硫化亚铁与稀硫酸反应 FeS+2H+═Fe2++H2S↑ | |
| C. | 硫酸铵和氢氧化钡溶液 Ba2++SO42-═BaSO4↓ | |
| D. | 氢氧化钡与稀硫酸反应 Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O |
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=akJ/mol
②2H2(g)+O2(g)═2H2O(g)△H2=bkJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H3=ckJ/mol
④2H2(g)+O2(g)═2H2O(1)△H4=dkJ/mol.
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.
| A. | 蔗糖溶于水 | B. | 氢气与氯气合成氯化氢 | ||
| C. | 氨气与氯化氢合成氯化铵 | D. | 加热KMnO4制O2 |
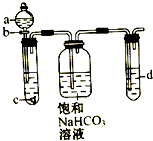 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.