题目内容
【题目】氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题:
Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。

(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。_________
(2)装置D的作用是_____________;实验中若不用装置C,可能产生的危险是____________。
(3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为:___________。
Ⅱ、SO2与漂粉精溶液的反应
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为________________________。
(6)用离子方程式解释现象3中黄绿色褪去的原因_______________________。
【答案】 e d j k b c(或cb) 液化BCl3使其从混合气体中分离出来 B与HCl反应生成H2,H2、Cl2混合受热发生爆炸 BCl3+3H2O=3HCl+H3BO3 碱性、漂白性 ClO-+Cl-+2H+=2H2O+Cl2↑ SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+(或SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
【解析】Ⅰ.(1)二氧化锰与浓盐酸加热反应,生成的氯气中含有杂质气体氯化氢和水蒸气,分别需用饱和食盐水和浓硫酸来除去,干燥纯净的氯气再与硼反应,由于BCl3的沸点12.5 ℃,
可以采用降温的方法,使BCl3变 为 液 态 物 质,最 后 多 余 的 尾 气 氯 气可以用碱石灰吸收,还能防止外界的水蒸气进入装置D中,正确的连接顺序:e d j k b c(或cb)。
(2)降低温度,使BCl3液 化,便 于分离,答 案 为液化BCl3使其从混合气体中分离出来。实验中若不用装置C,会有氯化氢气体进入装置B中,B与HCl反应生成H2,H2、Cl2混合受热发生爆炸,正确答案:B与HCl反应生成H2,H2、Cl2混合受热发生爆炸。
(3)盐酸挥发出氯化氢气体遇到水蒸气产生大量白雾,即盐酸,根据元素守恒规律,另外一种酸只能为硼酸,正确答案:BCl3+3H2O=3HCl+H3BO3。
Ⅱ.(4)漂粉精主要成分为次氯酸钙,它的水溶液中含有水解产生的次氯酸和强碱氢氧化钙,强碱使pH 试纸先变蓝,次氯酸具有漂白性,漂白了pH 试纸,试纸颜色褪去。
(5)溶液变为黄绿色是因为有反应生成的氯气溶解在溶液中造成,二氧化硫与水反应生成酸,在酸性条件下,溶液中ClO—和Cl—发生归中反应生成氯气,正确答案:ClO-+Cl-+2H+=2H2O+Cl2↑。
(6)反应产生的氯气和二氧化硫混合气体与水反应,生成盐酸和硫酸两种强酸,而硫酸根离子和溶液中的钙离子反应生成白色沉淀硫酸钙,氯气不断被消耗,溶液的颜色褪去,正确答案:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,Ca2++SO42-= CaSO4↓;
或SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如下图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是
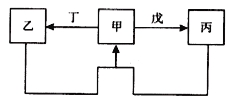
选项 | 假设 | 结论 |
A | 甲为S | 戊可能是氧气 |
B | 甲为Al(OH)3 | 丁可能是氢氧化钠溶液 |
C | 甲为Fe | 丁可能是硝酸 |
D | 甲为Na2CO3溶液 | 戊可能是CO2 |
A. A B. B C. C D. D