题目内容
【题目】在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图3所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是
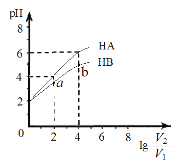
A. a、b两点水的电离程度a小于b
B. HA、HB两种酸溶液pH相同时,c(HA)
C. 曲线上a、b两点![]() 一定相等
一定相等
D. 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-)
【答案】D
【解析】在25℃下,稀释HA、HB两种酸溶液pH=2,加水稀释lg ![]() =2,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的pH<4,说明HB为弱酸。A. a、b两点HB的浓度a大于b,对水的电离的抑制程度a大于b,因此水的电离程度a小于b,故A正确;B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B正确;C.曲线上a、b两点
=2,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的pH<4,说明HB为弱酸。A. a、b两点HB的浓度a大于b,对水的电离的抑制程度a大于b,因此水的电离程度a小于b,故A正确;B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B正确;C.曲线上a、b两点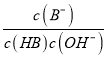 =
=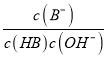 ×
×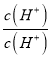 =
=![]() ,温度不变比值一定不变,故C正确;D.HA为强酸,HB为弱酸,25℃时,NaA是强酸强盐,不水解,NaB溶液中B-离子水解溶液显碱性,但没有告知NaA溶液和NaB溶液的浓度的大小,因此无法判断NaA溶液中c(A-)和NaB溶液中c(B-)的大小,故D错误;故选D。
,温度不变比值一定不变,故C正确;D.HA为强酸,HB为弱酸,25℃时,NaA是强酸强盐,不水解,NaB溶液中B-离子水解溶液显碱性,但没有告知NaA溶液和NaB溶液的浓度的大小,因此无法判断NaA溶液中c(A-)和NaB溶液中c(B-)的大小,故D错误;故选D。

 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题:
Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。

(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。_________
(2)装置D的作用是_____________;实验中若不用装置C,可能产生的危险是____________。
(3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为:___________。
Ⅱ、SO2与漂粉精溶液的反应
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为________________________。
(6)用离子方程式解释现象3中黄绿色褪去的原因_______________________。
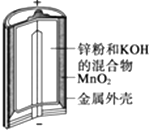
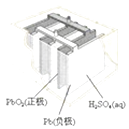
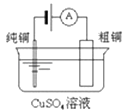
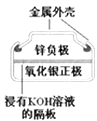
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag