题目内容
15.某学习小组同学用浓氨水、CaO、B2O3为原料制备材料制备超硬材料BN晶体,装置如图所示(已知:高温下BN能被空气氧化,BN不溶于水,B2O3难溶于水,可溶于热水)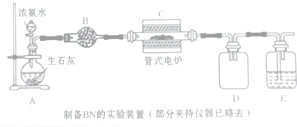
(1)仪器B的名称是干燥管,其中装的药品不可能是D(填序号)
A.氧化钙 B.碱石灰 C.烧碱 D.五氧化二磷
(2)写出C中发生反应的化学方程式:CaO+B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$Ca(OH)2+2NB+2H2O
(3)E装置中的试剂是浓硫酸(填试剂名称),E装置不能用B装置替代的原因是B中装的是碱性干燥剂,是用来干燥氨气,不能吸收氨气
(4)反应开始前的操作包括五个步骤:①组装仪器②检查装置气密性③装药品④打开分液漏斗活塞,排尽装置中空气⑤接通电炉电源加热,步骤④的目的是将装置中的空气排尽,以防止氧气在高温下氧化BN
(5)从反应结束后得到的固体混合物中提取纯净的BN固体,简要回答提纯BN固体的实验操作:将反应结束后得到的固体混合物溶于热水,再过滤.
分析 用浓氨水、CaO、B2O3为原料制备BN晶体,根据装置图可知,A装置中浓氨水遇生石灰产生氨气,经B装置干燥后,氨气在管式电炉中与CaO、B2O3反应,生成BN,反应中有氨气要用酸吸收,所以D装置是防倒吸装置,E装置为吸收氨气尾气的装置,
(1)根据装置图可知道,仪器B的名称是干燥管,其用来干燥氨气,氨气是碱性气体,据此判断;
(2)氨气在管式电炉中与CaO、B2O3反应,生成BN,根据元素守恒书写化学方程式;
(3)E装置为吸收氨气尾气的装置,据此答题;
(4)反应开始前要将装置中的空气排尽,以防止氧气在高温下氧化BN,据此答题;
(5)根据BN不溶于水,B2O2难溶于水,可溶于热水判断提纯BN固体的方法.
解答 解:用浓氨水、CaO、B2O3为原料制备BN晶体,根据装置图可知,A装置中浓氨水遇生石灰产生氨气,经B装置干燥后,氨气在管式电炉中与CaO、B2O3反应,生成BN,反应中有氨气要用酸吸收,所以D装置是防倒吸装置,E装置为吸收氨气尾气的装置,
(1)根据装置图可知道,仪器B的名称是干燥管,其用来干燥氨气,氨气是碱性气体,其中装的药品不可能是酸性氧化物,
故答案为:干燥管;D;
(2)氨气在管式电炉中与CaO、B2O3反应,生成BN,根据元素守恒书可知,反应的化学方程式为CaO+B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$Ca(OH)2+2NB+2H2O,
故答案为:CaO+B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$Ca(OH)2+2NB+2H2O;
(3)E装置为吸收氨气尾气的装置,所以E装置中的试剂是浓硫酸,因为B中装的是碱性干燥剂,是用来干燥氨气,不能吸收氨气,所以E装置不能用B装置,
故答案为:浓硫酸;B中装的是碱性干燥剂,是用来干燥氨气,不能吸收氨气;
(4)反应开始前要将装置中的空气排尽,以防止氧气在高温下氧化BN,所以反应开始前的操作包括五个步骤:①组装仪器②检查装置气密性③装药品④打开分液漏斗活塞,排尽装置中空气⑤接通电炉电源加热,
故答案为:装药品;打开分液漏斗活塞,排尽装置中空气;将装置中的空气排尽,以防止氧气在高温下氧化BN;
(5)根据BN不溶于水,B2O2难溶于水,可溶于热水可知,要提纯BN固体,可以将反应结束后得到的固体混合物溶于热水,再过滤,
故答案为:将反应结束后得到的固体混合物溶于热水,再过滤.
点评 本题主要考查物质的制备、分离提纯,难度中等,注意元素守恒思想的应用和实验基本操作的应用,可以培养学生综合分析问题和解决问题的能力.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | 0.04mol•L-1•s-1 | B. | 0.005mol•L-1•s-1 | ||
| C. | 0.01mol•L-1•s-1 | D. | 0.1mol•L-1•s-1 |
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1 mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g该氧原子的中子数一定为$\frac{8y}{a}$ |
| A. |  除去氯气中的氯化氢 | B. |  向容量瓶中转移溶液 | ||
| C. | 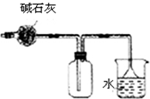 干燥并收集氨气 | D. |  保存浓硝酸 |
| A. | ADI(添加剂每日允许摄量)是衡量食品添加剂安全性的依据,值越高安全性就越高 | |
| B. | API(空气污染指数)是衡量空气质量好坏的重要指标,其值越大,空气质量就越好 | |
| C. | SPF是防晒霜对紫外线的防晒系数,其值越低,对紫外线的防护效果越好 | |
| D. | OTC是非处方药的简称.处方药是由医生选择的药物,所以它比非处方药安全系数大 |

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.

 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+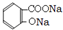 .
.