题目内容
【题目】已知下表数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-33 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A. 向该混合溶液中逐滴加入NaOH溶液: 最先看到红褐色沉淀
B. 该溶液中c(SO42-): [c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该溶液中加入适量氯水,并调节pH到4后过滤,可获得纯净的CuSO4溶液
D. 在:pH=5的溶液中Fe3+不能大量存在
【答案】C
【解析】A. 向混合溶液中逐滴加入NaOH溶液,开始生成Fe(OH)3时pH最小,所以最先看到红褐色沉淀,故A正确;B. 该溶液中c(SO42-)=2.5mol/L,由于Cu2+、Fe2+、Fe3+发生水解反应,使得c(Cu2+)+c(Fe2+)+c(Fe3+)<2.0mol/L,因此,c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4,故B正确;C. 向该溶液中加入适量氯水,Fe2+被氧化为Fe3+,溶液中含有氯化物,不能获得纯净的CuSO4溶液,故C不正确;D. 在pH=5的溶液中c(OH-)=1×10-9mol/L,Fe3+被完全沉淀时,c(Fe3+)≤1×10-5mol/L,c(OH-)≥( =(
=(![]() <1×10-9mol/L,所以在pH=5的溶液中.Fe3+不能大量存在,故D正确。故选C。
<1×10-9mol/L,所以在pH=5的溶液中.Fe3+不能大量存在,故D正确。故选C。

【题目】Ⅰ.工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:___________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
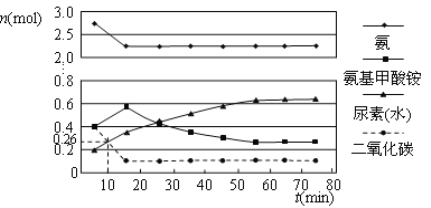
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。
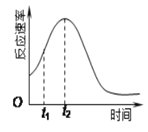
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:______________________
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、 1mL 0.05mol/L 酸性KMnO4, 少量_______固体 |
实验现象 | 褪色时间10min | 褪色时间____10min (选填“<” “>”或 “=”) |
结论 | 猜想Ⅱ正确 | |


