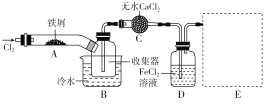
��Ŀ����
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������A�������к�����ḻ��Ԫ�أ�B��Cͬһ���壬��B��L���������K���������2.5����D��Cͬһ���ڣ�EԪ��ԭ�Ӻ��������17�ֲ�ͬ���˶�״̬��Fλ�ڵ������ڣ���δ�ɶԵ�����ֻ��һ�������ڲ㶼����ȫ����״̬����ش��������⣺
��1��Bԭ�ӵ�L������Ų�ͼ____________��
��2����A��Bԭ���γɵķ��ӵĽṹʽΪ��A-B=B-A����÷�������������������Ŀ֮��Ϊ________��B��C���⻯����BH3�ķе���� CH3�ķе㣬ԭ����___________��C��D��E�ĵ縺���ɴ�С��˳��Ϊ___________��C��D��E�ĵ�һ�������ɴ�С��˳����____________��C��D��ۺ����������������ǿ��˳��Ϊ_________________��CO![]() ��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��3����FDO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ_______�������ӵ���λ��Ϊ________________��
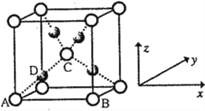
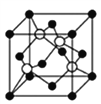
��4��D������F�������γɵ�ij�־���ľ�������ͼ��ʾ����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ___________g/cm3����ȷ��0.1��������ĺ���Ͱ���֮��ľ���Ϊ_______pm��
���𰸡� ![]() 3�U1 NH3���Ӽ�����γ���� Cl>S>P Cl>P>S H3PO4��H2SO4 sp3�ӻ� �������� [Cu(NH3)4]2+ NH3 4.6 129
3�U1 NH3���Ӽ�����γ���� Cl>S>P Cl>P>S H3PO4��H2SO4 sp3�ӻ� �������� [Cu(NH3)4]2+ NH3 4.6 129![]()
��������ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������A�������к�����ḻ��Ԫ�أ�AΪHԪ�أ�B��Cͬһ���壬��B��L���������K���������2.5����BΪNԪ�أ�CΪPԪ�أ�EԪ��ԭ�Ӻ��������17�ֲ�ͬ���˶�״̬��EΪClԪ�أ�Fλ�ڵ������ڣ���δ�ɶԵ�����ֻ��һ�������ڲ㶼����ȫ����״̬��FΪͭԪ�أ�C��D��E��ԭ��������������DΪSԪ�أ���A-H��B-N��C-P��D-S��E-Cl��F-Cu��
��1��BΪNԪ�أ�ԭ�ӵ�L��5�����ӣ������Ų�ͼ��![]() ����2����A��Bԭ���γɵķ��ӵĽṹʽΪ��H-N=N-H����÷�������������������Ŀ֮��Ϊ3��1��B��C���⻯����NH3�ķе���� PH3�ķе㣬ԭ����NH3���Ӽ�����γ���������Ӽ��������е������Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ縺�Դ�����������ͬһ����Ԫ�صĵ縺�Դ��ϵ�����С��C��D��E�ĵ縺���ɴ�С��˳��ΪCl>S>P����Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ�һ�����ܴ�����������ͬһ����Ԫ�صĵ�һ�����ܴ��ϵ�����С�������ڳ����Ͱ����״̬ʱ����һ�����ܱ��C��D��E�ĵ�һ�������ɴ�С��˳����Cl>P>S����Ԫ�����ڱ��У�ͬһ����Ԫ�ص���ۺ��������������ǿ��C��D��ۺ����������������ǿ��˳��ΪH3PO4��H2SO4 ��PO43����P�µ��Ӷ�Ϊ
����2����A��Bԭ���γɵķ��ӵĽṹʽΪ��H-N=N-H����÷�������������������Ŀ֮��Ϊ3��1��B��C���⻯����NH3�ķе���� PH3�ķе㣬ԭ����NH3���Ӽ�����γ���������Ӽ��������е������Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ縺�Դ�����������ͬһ����Ԫ�صĵ縺�Դ��ϵ�����С��C��D��E�ĵ縺���ɴ�С��˳��ΪCl>S>P����Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ�һ�����ܴ�����������ͬһ����Ԫ�صĵ�һ�����ܴ��ϵ�����С�������ڳ����Ͱ����״̬ʱ����һ�����ܱ��C��D��E�ĵ�һ�������ɴ�С��˳����Cl>P>S����Ԫ�����ڱ��У�ͬһ����Ԫ�ص���ۺ��������������ǿ��C��D��ۺ����������������ǿ��˳��ΪH3PO4��H2SO4 ��PO43����P�µ��Ӷ�Ϊ![]() =0������Ϊ4���۵��Ӷ�Ϊ4��PO43����P���ӻ���ʽΪ sp3�ӻ��������ӵ���VSEPR��ģ��Ϊ���������Ρ���3����CuSO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ[Cu(NH3)4]2+��NH3��Nԭ���ṩ�µ��Ӷԣ������ӵ���λ��ΪNH3����4��DΪS������FΪͭ�������γɵ�ij�־���ľ����У�Sԭ��8��1/8+6��1/2=4,ͭΪ4����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ
=0������Ϊ4���۵��Ӷ�Ϊ4��PO43����P���ӻ���ʽΪ sp3�ӻ��������ӵ���VSEPR��ģ��Ϊ���������Ρ���3����CuSO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ[Cu(NH3)4]2+��NH3��Nԭ���ṩ�µ��Ӷԣ������ӵ���λ��ΪNH3����4��DΪS������FΪͭ�������γɵ�ij�־���ľ����У�Sԭ��8��1/8+6��1/2=4,ͭΪ4����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ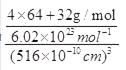 =
=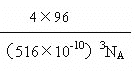 g/cm3 =4.6g/cm3����ȷ��0.1����������ⳤaΪ516 pm���ĸ�ͭ�����������ĸ�С����������ģ���ͭԭ����ױ������ߣ������ڵ���ֱ�������Σ����߷ֱ�Ϊ
g/cm3 =4.6g/cm3����ȷ��0.1����������ⳤaΪ516 pm���ĸ�ͭ�����������ĸ�С����������ģ���ͭԭ����ױ������ߣ������ڵ���ֱ�������Σ����߷ֱ�Ϊ![]() a��
a��![]() a,�����б��Ϊ
a,�����б��Ϊ![]() a,����ĺ���Ͱ���֮��ľ���Ϊ
a,����ĺ���Ͱ���֮��ľ���Ϊ![]() ��516 pm=129
��516 pm=129![]() pm��
pm��

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�