题目内容
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。请回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为 __________。
(2)NO3-的立体构型是_____,与NO3-互为等电子体的一种非极性分子为 _________(填化学式)。
(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是_____。
(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为(用箭头表示出配位键的位置)_______。
(5)化学实验室常利用新制氢氧化铜检验醛基的存在,乙醛分子中碳原子的杂化方式为 ___。
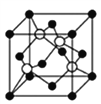
(6)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
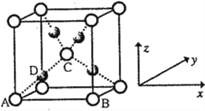
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______原子。
)。则D原子的坐标参数为________,它代表_______原子。
【答案】 3d9 N>O>S 平面三角形 BF3(或BCl3、BBr3等) CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 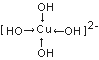 SP3、SP2 (
SP3、SP2 (![]() ;
;![]() ;
;![]() ) Cu
) Cu
【解析】(1)Cu2+电子排布式为[Ar]3d9,价电子排布式为3d9;同周期主族元素的第一电离能,随着原子序数的增大,有增大的趋势,但第VA族大于第VIA族元素,同主族元素,随着原子序数的增加,第一电离能逐渐减小,则S、O、N三种元素的第一电离能由大到小的顺序为:N>O>S;(2)对于NO3-,根据VSEPR理论,中心N原子的配位原子数为3,孤电子对数为![]() =0,则价电子对数为3+0=3,根据杂化轨道理论,中心N原子为sp2杂化,则其空间构型为平面三角形;等电子体是指原子数目相同,价电子数相同的粒子,则与NO3-互为等电子体的粒子有BF3,或BCl3,BBr3;(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,二者都是离子晶体,晶格能越大,熔点越高,晶格能和离子半径和离子电荷有关,离子电荷越高,半径越小,则: CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-,为配离子,OH-与Cu2+之间是配位键,用箭头表示,则不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为
=0,则价电子对数为3+0=3,根据杂化轨道理论,中心N原子为sp2杂化,则其空间构型为平面三角形;等电子体是指原子数目相同,价电子数相同的粒子,则与NO3-互为等电子体的粒子有BF3,或BCl3,BBr3;(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,二者都是离子晶体,晶格能越大,熔点越高,晶格能和离子半径和离子电荷有关,离子电荷越高,半径越小,则: CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-,为配离子,OH-与Cu2+之间是配位键,用箭头表示,则不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为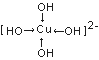 ;(5)乙醛分子的结构式为:
;(5)乙醛分子的结构式为: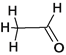 ,醛基为平面型,甲基为四面体型,则C的杂化方式有SP3、SP2;(6)①根据Cu2O的晶胞结构,已知A、B、C的原子坐标分别为(0,0,0),B(1,0,0),C(
,醛基为平面型,甲基为四面体型,则C的杂化方式有SP3、SP2;(6)①根据Cu2O的晶胞结构,已知A、B、C的原子坐标分别为(0,0,0),B(1,0,0),C(![]() ,
,![]() ,
,![]() ),根据立体几何知识,正四面体构型,D原子在AC之间的一半处,则D的原子坐标为(
),根据立体几何知识,正四面体构型,D原子在AC之间的一半处,则D的原子坐标为(![]() ,
,![]() ,
,![]() ),根据晶胞内粒子数目的关系,白色的原子有8×
),根据晶胞内粒子数目的关系,白色的原子有8×![]() +1=2个,黑色的原子有4个,因此D原子为Cu。
+1=2个,黑色的原子有4个,因此D原子为Cu。