题目内容
将质量为11.5g钠和一定量的铝混合放入水中,充分反应共收集到12.32L气体(标准状况),若反应后溶液的体积为1000mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程)
考点:化学方程式的有关计算
专题:计算题
分析:发生反应有:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成的气体为氢气,根据n=
计算11.5g Na的物质的量,根据方程式计算Na反应生成氢气的物质的量、生成NaOH的物质的量,进而计算Al反应生成氢气的物质的量,根据方程式计算n(NaAlO2)、Al反应消耗的NaOH,进而计算剩余NaOH,再根据c=
计算各自浓度.
| m |
| M |
| n |
| V |
解答:
解:11.5g Na的物质的量=
=0.5mol,生成氢气的物质的量=
=0.55mol,则:
2Na+2H2O=2NaOH+H2↑
0.5mol 0.5mol 0.25mol
故Al反应生成氢气为:0.55mol-0.25mol=0.3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 0.3mol
故最终溶液中NaOH为0.5mol-0.2mol=0.3mol、NaAlO2为0.2mol
则溶液中c(NaOH)=
=0.3mol/L、c(NaAlO2)=
=0.2mol/L
答:溶液中NaOH为0.3mol/L,NaAlO2为0.2 mol/L.
| 11.5g |
| 23g/mol |
| 12.32L |
| 22.4L/mol |
2Na+2H2O=2NaOH+H2↑
0.5mol 0.5mol 0.25mol
故Al反应生成氢气为:0.55mol-0.25mol=0.3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 0.3mol
故最终溶液中NaOH为0.5mol-0.2mol=0.3mol、NaAlO2为0.2mol
则溶液中c(NaOH)=
| 0.3mol |
| 1L |
| 0.2mol |
| 1L |
答:溶液中NaOH为0.3mol/L,NaAlO2为0.2 mol/L.
点评:本题考查化学方程式有关计算、混合物的有关计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
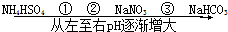 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )| A、NH4NO3、(NH4)2SO4、CH3COONa |
| B、(NH4)2SO4、NH4Cl、C6H5ONa |
| C、(NH4)2SO4、NH4NO3、Na2CO3 |
| D、(NH4)2SO4、NH4NO3、CH3COONa |
某1L的混合溶液中,含有1mol Fe2+、2mol Fe3+,加入2mol还原铁粉,待反应停止后,溶液中Fe2+的物质的量浓度为(假设反应前后溶液体积不变)( )
| A、7mol?L-1 |
| B、5mol?L-1 |
| C、4mol?L-1 |
| D、3mol?L-1 |
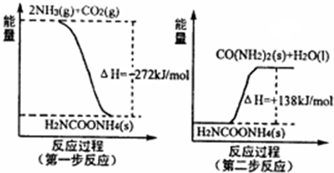 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.