题目内容
14.下列叙述中错误的是( )| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO和2 mol N2含原子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
分析 A、摩尔质量的单位为g/mol;
B、NO和氮气均为双原子分子;
C、氧气和臭氧均由氧原子构成;
D、CO和二氧化碳中均含一个碳原子.
解答 解:A、摩尔质量的单位为g/mol,故硫酸的摩尔质量为98g/mol,故A错误;
B、NO和氮气均为双原子分子,故2molNO和2mol氮气中均含4mol原子,故B正确;
C、氧气和臭氧均由氧原子构成,故等质量的氧气和臭氧中含有的氧原子的物质的量相同,故C正确;
D、CO和二氧化碳中均含一个碳原子,故等物质的量的CO和二氧化碳中含有的碳原子的个数相同,故D正确.
故选A.
点评 本题考查了摩尔质量的单位和原子个数的计算,难度不大,注意基础的掌握.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 | |
| B. | H2O与H2S的空间结构一样是由共价键的饱和性决定的 | |
| C. | 并非所有的共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
6.在酸性溶液中,可大量共存且形成无色溶液的是( )
| A. | Ba2+、NO3-、Cl-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Ca2+、Na+、Cl-、SO42- | D. | K+、Cl-、Al3+、OH- |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2gH2所含的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有水分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的MgCl2溶液中含有的Cl-数为0.2NA | |
| D. | 常温常压下,11.2L CH4中含有的氢原子数为2NA |
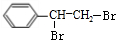 ,等物质的量的A、D完全燃烧生成水的质量之比为5:4;
,等物质的量的A、D完全燃烧生成水的质量之比为5:4;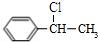 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$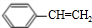 +NaCl+H2O;
+NaCl+H2O;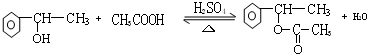 .
.
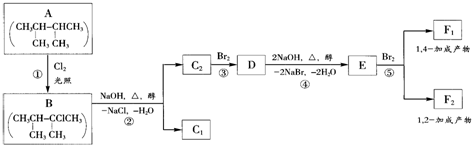
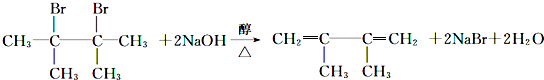 .
.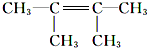 .F1的结构简式是
.F1的结构简式是 .
.