题目内容
6.在酸性溶液中,可大量共存且形成无色溶液的是( )| A. | Ba2+、NO3-、Cl-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Ca2+、Na+、Cl-、SO42- | D. | K+、Cl-、Al3+、OH- |
分析 酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.Fe3+为黄色,与无色不符,故B不选;
C.Ca2+、SO42-结合生成微溶物,不能大量共存,故C不选;
D.Al3+、OH-结合生成沉淀,且H+、OH-结合生成水,不能大量共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
16.如图所示,下列叙述正确的是( )
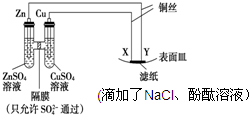

| A. | 电子从Cu极流出,流入X极 | B. | 滤纸中的Cl-向Y极移动 | ||
| C. | Y为滤纸接触处有氢气生成 | D. | X与滤纸接触处变红 |
14.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO和2 mol N2含原子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
1.当光束通过下列物质的时候,能观察到丁达尔效应的是( )
| A. | 豆浆 | B. | 硫酸铜溶液 | C. | 蒸馏水 | D. | 食盐水 |
11.一定条件下,在体积为5L的密闭容器中,0.5mol X和0.5mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.15mol Z,下列说法正确的是( )
| A. | 平衡后充入氦气,平衡正向移动 | |
| B. | 以X浓度变化表示反应速率:v(X)=0.001 mol/(L•s) | |
| C. | 平衡后升高温度Y的转化率减小,则正反应为吸热反应 | |
| D. | 达到平衡时,X与Y 的浓度相等 |
15.下列式子中,能真实表示物质分子组成的是( )
| A. | SiO2 | B. | C | C. | CH4 | D. | NH4Cl |
1.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗产品.
②有关物质的部分性质如下表
设计实验装置图如下:

(1)上图中尾气处理装置不够完善,请你提出改进意见:在G和H之间增加干燥装置.
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E中反应的化学方程式:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(3)仪器B的名称是圆底烧瓶,C中的试剂是饱和食盐水,所起的作用是除去氯气中的氯化氢气体,粗S2Cl2产品收集在装置G中(填字母).
(4)将纯净的S2Cl2溶于足量的NaOH溶液中,发生的反应化学方程式为2S2Cl2+6NaOH═4NaCl+Na2SO3+3H2O+3S↓,
(5)为进一步检验(4)反应后溶液中大量存在的阴离子,某兴趣小组设计了如下实验:
①在所得液体中加入CS2,振荡,淡黄色固体溶解,混合液分层,该操作为萃取;
②进行分液(填操作名称),取所得上层清液继续进行实验;
③检验溶液中的阴离子(限选的试剂有:酚酞溶液、Ba(NO3)2溶液、AgNO3溶液、盐酸、稀HNO3、KMnO4溶液)
①干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗产品.
②有关物质的部分性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S 3000C以上完全分解 |

(1)上图中尾气处理装置不够完善,请你提出改进意见:在G和H之间增加干燥装置.
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E中反应的化学方程式:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(3)仪器B的名称是圆底烧瓶,C中的试剂是饱和食盐水,所起的作用是除去氯气中的氯化氢气体,粗S2Cl2产品收集在装置G中(填字母).
(4)将纯净的S2Cl2溶于足量的NaOH溶液中,发生的反应化学方程式为2S2Cl2+6NaOH═4NaCl+Na2SO3+3H2O+3S↓,
(5)为进一步检验(4)反应后溶液中大量存在的阴离子,某兴趣小组设计了如下实验:
①在所得液体中加入CS2,振荡,淡黄色固体溶解,混合液分层,该操作为萃取;
②进行分液(填操作名称),取所得上层清液继续进行实验;
③检验溶液中的阴离子(限选的试剂有:酚酞溶液、Ba(NO3)2溶液、AgNO3溶液、盐酸、稀HNO3、KMnO4溶液)
| 实验步骤 | 实验现象和结论 |
| 1.取少量溶液于试管中,滴入几滴KMnO4溶液 | KMnO4溶液颜色由紫色变绿色,说明溶液中大量存在SO32- |
| 2.另取少量溶液于试管中,加入2-3滴酚酞溶液 | 溶液颜色由无色变红,说明溶液中大量存在OH- |
| 3.另取少量溶液于试管中,加入足量1mol•L-1HNO3,再加入少量AgNO3溶液 | 仍有白色沉淀产生,说明溶液中大量存 |