题目内容
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:
(1)写出下列元素的符号A ,D ,E ;
(2)用电子式表示B、F形成的化合物 ;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 ;
(4)D的固态氧化物是 晶体.含n mol D的氧化物的晶体中含D﹣0共价键为 mol.
【答案】(1)Na;Si;P;
(2)![]() ;
;
(3)Al(OH)3+OH﹣═AlO2﹣+2H2O;
(4)原子;4n.
【解析】试题分析:A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8﹣4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8﹣3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11﹣1﹣3=7,则F为Cl元素,结合原子序数可知B为Mg,据此进行解答.
解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8﹣4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8﹣3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11﹣1﹣3=7,则F为Cl元素,结合原子序数可知B为Mg,
(1)由上述分析可知,A为Na,D为Si,E为为P,
故答案为:Na;Si;P;
(2)B、F形成的化合物为氯化镁,用电子式表示其形成过程为![]() ,
,
故答案为:![]() ;
;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣═AlO2﹣+2H2O;
(4)D为Si元素,其氧化物为二氧化硅,二氧化硅属于原子晶体;Si能形成4个共价键,nmol二氧化硅中含有nmolSi原子,所以nmol二氧化硅含4nmolSi﹣O键,
故答案为:原子;4n.

【题目】为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
选项 | 物质 | 大气中的含量 (体积百分比) | 温室效应指数 |
A | H2 | 2 | 0 |
B | O2 | 21 | 0 |
C | H2O | 1 | 0.1 |
D | CO2 | 0.03 | 1 |
E | CH4 | 2×10﹣4 | 30 |
F | N2O | 3×10﹣5 | 160 |
G | O3 | 4×10﹣5 | 2000 |
H | CCl3F | 2.8×10﹣8 | 21000 |
I | CCl2F2 | 4.8×10﹣4 | 25000 |
(1)下列由极性键形成的极性分子是 .
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是 .
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 .
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的是 .
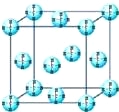
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH446H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为: .
