��Ŀ����
����Ŀ��Ϊ�˱Ƚ�����ЧӦ�����Ŀǰȫ�����������Ӱ�죬��ѧ��ͨ�����á�����ЧӦָ�������Զ�����̼Ϊ��Ա�����1�У�A������I�������������ڴ����е�����ٷֱȼ�������ЧӦָ������ϱ����г��ľ������壬�Բ���ش����и��⣺
ѡ�� | ���� | �����еĺ��� ������ٷֱȣ� | ����ЧӦָ�� |
A | H2 | 2 | 0 |
B | O2 | 21 | 0 |
C | H2O | 1 | 0.1 |
D | CO2 | 0.03 | 1 |
E | CH4 | 2��10��4 | 30 |
F | N2O | 3��10��5 | 160 |
G | O3 | 4��10��5 | 2000 |
H | CCl3F | 2.8��10��8 | 21000 |
I | CCl2F2 | 4.8��10��4 | 25000 |
��1�������ɼ��Լ��γɵļ��Է����� ��
A��N2 B��O2 C��H2O D��CO2E��CH4
��2������˵������ȷ���� ��
A��N2O��CO2��CCl3F��CCl2F2��Ϊ�ȵ�����
B��CCl2F2��ͬ���칹�壬˵������̼ԭ�Ӳ���sp3��ʽ�ӻ�
C��CH4��Ŀǰ��������ЧӦ����Ҫԭ��
D��H2O�е��Ǿ�����������ߵģ�����Ϊˮ���Ӽ����γ����
��3���ڰ뵼��������������ʹ���У����������ɢ�����磺NF3��CHClFCF3��C3F8�������������ģ���Щȷ��ǿ�������壬�����Ʋⲻ��ȷ���� ��
A���ɼ۲���ӶԻ������ۿ�ȷ��NF3���ӳ�������
B��C3F8��CCl4�е��ܽ�ȱ�ˮ�д�
C��CHClFCF3���������칹
D����һ�����ܣ�N��O��F
��4�����龧��ľ����ṹ��ͼ�������й�˵����ȷ���� ��
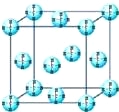
A�������ڳ����³���̬��˵�����龧�����ڷ��Ӿ���
B��������1��CH4������12�����ڵļ������
C�� CH4�����ۻ�ʱ��˷����ۼ�
D����ȼ����8CH446H2O�����ڵ��¸�ѹ���γɵľ���
��5�����������ڻ�̬ʱ��������Ų�ʽΪ�� ��
���𰸡���1��C��
��2��C��
��3��D��
��4��ABD��
��5��1s22s22p63s23p63d6��
��������
�����������1����ͬԪ��ԭ��֮���γɼ��Լ������ݷ��ӿռ乹���жϷ��Ӽ��ԣ�
��2��A��ԭ��������ȣ��۵������������������ȵ���Ϊ�ȵ����壻
B��CCl2F2��ͬ���칹�壬˵������Ϊ������ṹ���ݴ��жϣ�
C��Ŀǰ��������ЧӦ����Ҫԭ���Ƕ�����̼��
D�������ڷ��Ӿ��壬H2O����֮�����������е���ߣ�
��3��A������Nԭ�Ӽ۲���Ӷ�����¶Ե����ж�NF3���ӿռ乹�ͣ�
B���л����������л��ܽ⣻
C����������̼ԭ�ӷ����������칹������4����ͬ���Ż�ԭ�ӵ�̼ԭ��Ϊ����̼ԭ�ӣ�
D��ͬ�����������Ԫ�ص�һ�����ܳ��������ƣ����NԪ��2p�ܼ�Ϊ�����ȶ��ṹ������
��4��A�������ڳ����³���̬��˵������е�ܵͣ��������ڷ��Ӿ��壻
B���Զ���������Ϊ�о�������֮����ļ������λ�����ģ�ÿ���������Ϊ12���湲�ã�
C�� CH4�������ڷ��Ӿ��壻
D�������¼���Ϊ��̬��ˮΪҺ̬���γɿ�ȼ����8CH446H2O�����������Ӧ�ǵ��¸�ѹ��
��5��������ΪCo3+�����Ӻ��������Ϊ24�����ݹ���ԭ����д��
�⣺��1��N2��O2 �������Լ���Ϊ�Ǽ��Է��ӣ�H2O��CO2��CH4�����м��Լ���H2OΪV�ͣ����Ӳ��Գƣ�Ϊ���Է��ӣ�CO2Ϊֱ���͡�CH4Ϊ���������ͣ�Ϊ�Գƽṹ�����ڷǽ����Է��ӣ�
�ʴ�Ϊ��C��
��2��A��N2O��CO2ԭ����������ҵ���������ȣ�����Ϊ�ȵ����壬CCl3F��CCl2F2ԭ����������Ҽ۵�������������Ϊ�ȵ����壬��A��ȷ��
B��CCl2F2��ͬ���칹�壬˵������Ϊ������ṹ��̼ԭ�Ӳ���sp3��ʽ�ӻ�����B��ȷ��
C��Ŀǰ��������ЧӦ����Ҫԭ���Ƕ�����̼�����Ǽ��飬��C����
D.9�����ʶ����ڷ��Ӿ��壬H2O����֮����������9��������ˮ�е���ߣ���D��ȷ��
�ʴ�Ϊ��C��
��3��A��NF3������Nԭ�Ӽ۲���Ӷ���=3+![]() =4����1�Թµ��Ӷԣ�����Ϊ�����Ϳռ乹�ͣ���A��ȷ��
=4����1�Թµ��Ӷԣ�����Ϊ�����Ϳռ乹�ͣ���A��ȷ��
B��C3F8�����л���������л��ܼ���C3F8��CCl4�е��ܽ�ȱ�ˮ�д�B��ȷ��
C��CHClFCF3�����д�������̼ԭ�ӣ�����Hԭ�ӵ�̼ԭ�ӣ����ʴ��������칹����D��ȷ��
D��ͬ�����������Ԫ�ص�һ�����ܳ��������ƣ���NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������O��N��F����D����
�ʴ�Ϊ��D��
��4��A�������ڳ����³���̬��˵������е�ܵͣ��������ڷ��Ӿ��壬��A��ȷ��
B���Զ���������Ϊ�о�������֮����ļ������λ�����ģ�ÿ���������Ϊ12���湲�ã��ʾ�����1��CH4������12�����ڵļ�����ӣ���B��ȷ��
C��CH4�������ڷ��Ӿ��壬�ۻ�ʱ��˷����Ӽ�����������C����
D�������¼���Ϊ��̬��ˮΪҺ̬���γɿ�ȼ����8CH446H2O�����������Ӧ�ǵ��¸�ѹ����D��ȷ��
�ʴ�Ϊ��ABD��
��5��������ΪCo3+�����Ӻ��������Ϊ24�����������Ų�Ϊ��1s22s22p63s23p63d6��
�ʴ�Ϊ��1s22s22p63s23p63d6��

 ��У����ϵ�д�
��У����ϵ�д�