题目内容
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。
(1)G的元素符号是_________原子的价电子排布图为______________
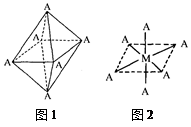
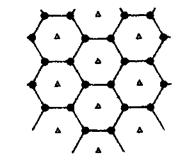
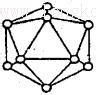
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________
(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式)
(1)G的元素符号是_________原子的价电子排布图为______________
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________

(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式)
(1) Cr (1分) 3d54s1 (1分)
(2)20 (1分)
(3)NH3>PH3 (1分) 原因:N中心原子的电负性大,使得NH3中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大。 (2分)
(4)ab (2分)
(5)面心立方最密堆积 (1分) 略 (1分)
(2)20 (1分)
(3)NH3>PH3 (1分) 原因:N中心原子的电负性大,使得NH3中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大。 (2分)
(4)ab (2分)
(5)面心立方最密堆积 (1分) 略 (1分)
试题分析:由化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13可知甲为NaOH,A为H、D为O、E为Na,B、F同主族,F是重要的半导体材料,B为C、F为Si,G为前四周期单电子数最多的元素,H最外层电子数与G相同,故G为Cr、H为Cu、C为N (1) Cr 3d54s1
(2)元素I为B,由B12图可知:每个B原子被五个正三角形共用,故正三角形的个数:12×5/3=20个
(3)原因:N中心原子的电负性大,使得NH3中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大,NH3>PH3。
(4)B与D两元素组成的常见无机粒子有CO32-为平面三角形;CO2、CO为直线型。
(5)面心立方最密堆积 最近两个H原子间的距离为面对角线的一半,结果略。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

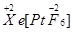 、
、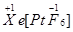 两种可能,经证实
两种可能,经证实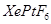 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定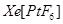 中化学键类型为________。
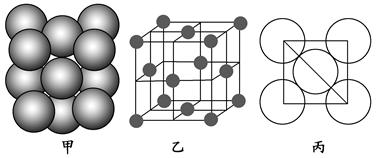
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,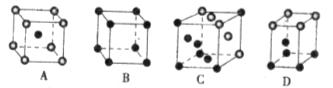
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1)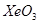 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性,