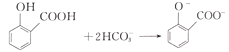题目内容
【题目】现有三种常见元素的性质或结构如下表:
X | 与Al同周期,金属性最强 |
Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
W | 单质紫黑色,遇淀粉溶液显蓝色 |
(1)X元素的名称是___;Y的原子结构示意图是___;W在元素周期表中的位置是___;
(2)请写出Z的单质与X元素最高价氧化物所对应水化物的溶液在常温下反应的离子方程式___;
(3)判断非金属性Z___Y(填“>”或“<”),请用离子方程式进行说明:___。
【答案】钠  第五周期第ⅦA族 Cl2+2OH-=Cl-+ClO-+H2O > Cl2+S2-=S↓+2Cl-或Cl2+H2S=S↓+2Cl-+2H+
第五周期第ⅦA族 Cl2+2OH-=Cl-+ClO-+H2O > Cl2+S2-=S↓+2Cl-或Cl2+H2S=S↓+2Cl-+2H+
【解析】
X与Al同周期,金属性最强,则X是钠;Y与Al同周期,最外层电子数是最内层电子数的3倍,因此最外层电子数是6个,即为S元素;Z常温下单质为双原子分子,为黄绿色有毒气体,因此Z是氯元素;W单质紫黑色,遇淀粉溶液显蓝色,则W是I。
(1)根据以上分析可知X元素的名称是钠;S的原子结构示意图是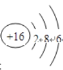 ;I在元素周期表中的位置是第五周期第ⅦA族,故答案为:钠;
;I在元素周期表中的位置是第五周期第ⅦA族,故答案为:钠;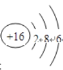 ;第五周期第ⅦA族;
;第五周期第ⅦA族;
(2)X元素最高价氧化物所对应水化物为NaOH,Z的单质是Cl2,两者在常温下反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)氯气能把硫化钠中硫离子氧化为单质S,这说明氯元素的非金属性强于S,反应的离子方程式为Cl2+S2-=S↓+2Cl-或Cl2+H2S=S↓+2Cl-+2H+,故答案为:Cl2+S2-=S↓+2Cl-或Cl2+H2S=S↓+2Cl-+2H+。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。