题目内容
室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)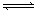 XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30% ④ X="2"
其中正确的是
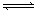 XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法: ①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30% ④ X="2"
其中正确的是
| A.①③④ | B.①④ | C.②③ | D.③④ |
A
试题分析:由题意: 2A(g)+B(g)
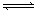 XC(g)
XC(g)起始浓度(mol/L)2 1 0
变化浓度(mol/L)0.6 0.3 0.6
2s后平衡(mol/L)1.4 0.7 0.6
所以①用A表示的反应速率为0.6mol/L÷2s="0.3" mol/(L·s);②反应前容器内的压强与平衡后容器内的压强之比等于物质的量之比等于(2+1):(1.4+0.7+0.6)=3:2.7=1:0.9;③2 s 时物质A的转化率为30%;④浓度变化量之比等于化学计量数之比,故X=2。

练习册系列答案
相关题目
 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。

 X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: 1
1

 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)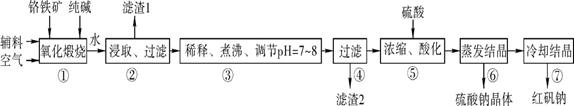
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2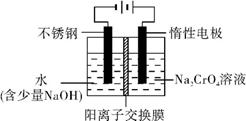
 可用于检测CO,反应原理为:
可用于检测CO,反应原理为:
 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量 随时间的变化如下图所示。
随时间的变化如下图所示。
 _____________。
_____________。 的体积分数
的体积分数 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。 ______________。
______________。 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。