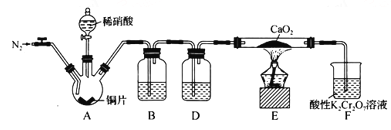
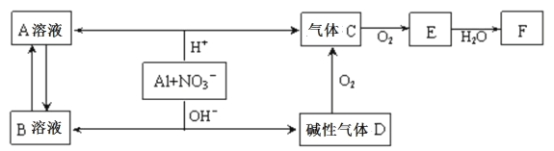
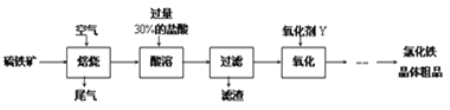
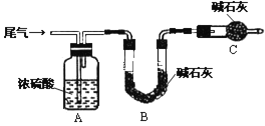
题目内容
【题目】下列有关说法正确的是
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀) > HNO3(浓)
NO2可知,氧化性:HNO3(稀) > HNO3(浓)
D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
【答案】D
【解析】
A选项,在氯气与氢氧化钠反应中,1 mol Cl2参加反应转移电子数为NA,故A错误;
B选项,在反应KIO3 + 6HI = KI + 3I2 +3H2O中,碘元素化合价由+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,所以每生成3 mol I2转移电子数为5NA,故B错误;
C选项,不能根据还原产物的价态确定氧化剂氧化性的强弱,实际上氧化性:HNO3(稀) < HNO3(浓),故C错误;
D选项,酸性条件下NO3-具有强氧化性,能氧化Fe2+,所以含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-,故D正确。
综上所述,答案为D。

【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度 | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5 mol、1.8 mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
【题目】下列有关离子反应的说法正确的是( )
选项 | 离子方程式 | 评价 |
A | 将2molCl2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2= 2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ | 正确;阳极氯离子放电,阴极氢离子放电 |
C | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2一 + 4NH4++ 2H2O | 正确;氨水过量,氢氧化铝能溶于过量的碱 |
D | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | 错误;电荷不守恒,生成物中应有亚铁离子 |
A.AB.BC.CD.D