题目内容
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |

则K1,K2,K3之间的关系为K2=______________,△H3=_____________
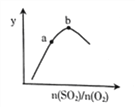
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。

(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
【答案】 K12/K3 2△H1-△H2 A D 图1 20.00 D c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 2NH3-6e-+3O2-=N2+3H2O B
【解析】(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)
③4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-③可得:2NO(g)+Cl2(g)2ClNO(g),则平衡常数K2=K12/K3 ;△H2=2△H1-△H3,则△H3=2△H1-△H2,
(2)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点;当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大,为D;
(3)①醋酸为弱电解质,醋酸为弱酸,溴化氢为强电解质,0.1mol/L的HBr溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定HBr溶液的曲线是图1;
②根据图1中溴化氢与氢氧化钠等物质的量时,溶液为中性,则a点时NaOH溶液 的体积为20.00mL;
③根据电荷守恒可知,当c(Na+)=c(CH3COO-)时溶液显中性,即图中D点,此时pH=7,c(Na+)=c(CH3COO-);
④E点时溶液为CH3COONa,溶液显碱性,c(H+)<c(OH-),根据电荷守恒可知,对应溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ;
(4) 该燃料电池中通入氨气的一极为负极,发生氧化反应,电极反应式为 2NH3-6e-+3O2-=N2+3H2O;
(5)Ksp(NiCO3)>Ksp(CdCO3),则最先沉淀的是Cd2+,沉淀完全时溶液中 c(CO32-) =Ksp(CdCO3)÷c(Cd2+)=(6.0×10-12)÷(1.0×10-5)=6.0×10-7mol/L,此时p(CO32-)=-lgc(CO32-) =-lgc(6.0×10-7)=7-lg6;当Ni2+开始沉淀时c(CO32-) =Ksp(NiCO3)÷c(Ni2+)=(1.0×10-7)÷(0.01)=1.0×10-5mol/L,此时p(CO32-)=-lgc(CO32-) =-lgc(1.0×10-5)=5,分离这两种阳离子,需要控制p(CO32-)范围为5<p(CO32-)≤ 7-lg6,答案为B。