题目内容
【题目】燃煤烟气中的SO2、NOx是形成酸雨的有害物质。应设法吸收利用。
I.吸收SO2:通入氨水将其转化为NH4HSO3,NH4HSO3溶液呈_____性(填“酸”、“碱”、“中”);再通空气将NH4HSO3氧化,溶液pH将__________(填“增大”、“减小”、“不变”)
Ⅱ.处理NO:先用O3处理,再用Na2SO3溶液吸收。O3处理的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=akJ·mol-1
NO2(g)=NO(g)+1/2O2(g) △H=bkJ·mol-1
(1)反应NO(g)+O3(g)=3NO2(g)的△H=_______kJ·mol-1。
(2)用Na2SO3溶液吸收时,溶液中SO32-将NO2转化为NO2-,反应的氧化产物是_________。
Ⅲ.利用SO2:分离出SO2可用于生产硫酸,反应之一:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
(3)恒温恒容下,改变SO2、O2的物质的量之比[n(SO2)/n(O2)],平衡时测定Y的值,Y与[n(SO2)/n(O2)]的关系如图所示,则Y可能是______________。
A.正反应速率 B.SO3的体积分数 C.SO2的转化率 D.SO2的体积分数
a→b段y变化的原因是___________。

(4)Kp是以各气体平衡分压(各气体的分压=总压×各气体的体积分数)代替平衡浓度表示的平衡常数。
①Kp与温度(T/K)的关系是㏒Kp=![]() -4.86(R为常数),请判断R___0(填“>”或“<”),原因是________。
-4.86(R为常数),请判断R___0(填“>”或“<”),原因是________。
②在10.0%SO2、13.5%O2、76.5%N2(体积分数)时,SO2平衡转化率与温度、压强的关系如图。

则x_____1.0(填“>”或“<”);计算550℃、1.0atm下,2SO2(g)+O2(g)![]() 2SO3(g)的Kp=____。(精确到1位小数)
2SO3(g)的Kp=____。(精确到1位小数)
【答案】 酸性 减小 a-2b SO42- AB SO2浓度增大,正反应速率增大,平衡正移,SO3增多 > 温度(T)升高,平衡逆向移动,Kp减小,由关系式可判断R>0 > 859.5 atm-1
【解析】I. 亚硫酸属于中强酸,NH4HSO3溶液显酸性;再通空气将NH4HSO3氧化生成(NH4)2SO4和硫酸,溶液的酸性增强,pH将减小,故答案为:酸性;减小;
Ⅱ.(1)①NO(g)+O3(g)=NO2(g)+O2(g) △H=akJ·mol-1,②NO2(g)=NO(g)+1/2O2(g) △H=bkJ·mol-1,根据盖斯定律,将①-②×2得:NO(g)+O3(g)=3NO2(g) △H=(a-2b )kJ·mol-1,,故答案为:a-2b;
(2) SO32-将NO2转化为NO2-,反应中N元素的化合价由+4价变成+3价,被还原,则S元素化合价由+4价变成+6价被氧化,反应的氧化产物为SO42-,故答案为:SO42-;
Ⅲ. (3) A. 根据图像,增大SO2、O2的物质的量之比[n(SO2)/n(O2)],可以是充入二氧化硫,正反应速率增大,随着反应的进行,正反应速率又逐渐减小,故A正确;B. 可以是充入二氧化硫,平衡正向移动,SO3的体积分数增大,当充入的二氧化硫到一定沉淀时,三氧化硫的体积分数得到最大,随后又逐渐减小,故B正确;C. 增大SO2、O2的物质的量之比[n(SO2)/n(O2)],SO2的转化率减小,故C错误;D. 充入的二氧化硫越多,SO2的体积分数越大,故D错误;a→b段y变化的原因是SO2浓度增大,正反应速率增大,平衡正移,SO3增多,故选AB;SO2浓度增大,正反应速率增大,平衡正移,SO3增多;
(4) ①2SO2(g)+O2(g)![]() 2SO3(g) △H<0,温度(T)升高,平衡逆向移动,Kp减小,由㏒Kp=
2SO3(g) △H<0,温度(T)升高,平衡逆向移动,Kp减小,由㏒Kp=![]() -4.86可判断R>0,故答案为:>;温度(T)升高,平衡逆向移动,Kp减小,由关系式可判断R>0;
-4.86可判断R>0,故答案为:>;温度(T)升高,平衡逆向移动,Kp减小,由关系式可判断R>0;
②2SO2(g)+O2(g)![]() 2SO3(g)属于反应后气体的物质的量减小的反应,增大压强,其他条件不变时,SO2平衡转化率增大,因此x>1.0,550℃、1.0atm下,SO2平衡转化率为90%,设反应前气体的总物质的量为100mol,则SO2为10mol, O2为13.5mol,76.5N2为76.5mol。
2SO3(g)属于反应后气体的物质的量减小的反应,增大压强,其他条件不变时,SO2平衡转化率增大,因此x>1.0,550℃、1.0atm下,SO2平衡转化率为90%,设反应前气体的总物质的量为100mol,则SO2为10mol, O2为13.5mol,76.5N2为76.5mol。
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始(mol) 10 13.5 0
反应 9 4.5 9
平衡 1 9 9
平衡分压(atm) ![]()
![]()
![]()
Kp= =859.5 atm-1,故答案为:> ; 859.5 atm-1。
=859.5 atm-1,故答案为:> ; 859.5 atm-1。

【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
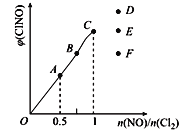
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
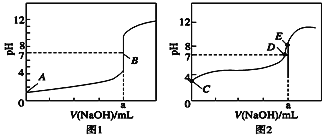
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
【题目】在下表中,只用一种试剂Z来检验盐溶液中的离子X。在同时有离子Y存在时,此检验仍可以判断的是( )
试剂Z | 离子X | 离子Y | |
A | Na2CO3 | Ca2+ | Ba2+ |
B | AgNO3 | Cl- | CO32- |
C | Na2SO4 | Ba2+ | Mg2+ |
D | Ba(NO3)2 | SO42- | CO32- |
A. A B. B C. C D. D
