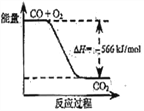
题目内容
【题目】25℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是
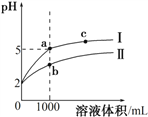
A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液
D. 将a、b两溶液加热至30℃,![]() 变小
变小
【答案】C
【解析】A.稀释相同倍数,I的pH变化大,则I应为盐酸稀释时的pH值变化曲线,故A正确;B.溶液导电性取决于离子浓度,a点的H+浓度大,离子总浓度大于c点,a点导电性强,故B正确;C.b点溶液中存在未电离的醋酸,其中和NaOH能力比HCl溶液强,故C错误;D.将a、b两溶液加热至30℃,a中c(Cl-)不变,加热促进醋酸的电离,c(CH3COO-)增大,则![]() 变小,故D正确;故选C。
变小,故D正确;故选C。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
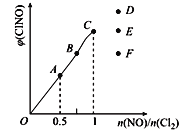
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
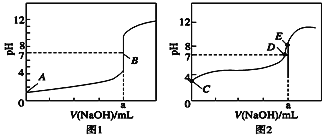
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8