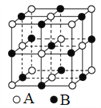
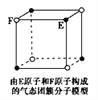
题目内容
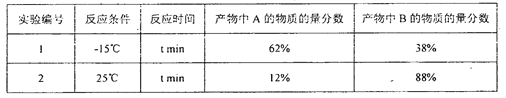
【题目】一定温度时,Cu2+,Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是
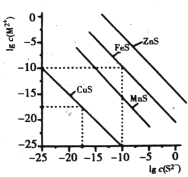
A. 该温度下,Ksp(MnS)大于1.0×10-15
B. 该温度下,溶解度:CuS>MnS>FeS>ZnS
C. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
D. 向c(Fe2+)=0.1mol/L的溶液中加入CuS粉末,有FeS沉淀析出
【答案】B
【解析】A项,MnS饱和溶液中存在沉淀溶解平衡:MnS(s)![]() Mn2+(aq)+S2-(aq),其溶度积常数为Ksp=c(Mn2+)c(S2-),根据图像可计算Ksp(FeS)=c(Fe2+)c(S2-)=1×10-20,Ksp(CuS)=c(Cu2+)c(S2-)=1×10-35,MnS的曲线在CuS的上方、在FeS下方,因此Ksp(MnS)大于Ksp(CuS)、小于Ksp(FeS),即1.0×10-35<Ksp(MnS)<1×10-20,故A正确;B项,根据图像,Ksp(CuS)最小,其次是Ksp(MnS)、Ksp(FeS),最大的是Ksp(ZnS),同类型物质,在相同条件下,溶度积大的,溶解度也大,因此溶解度关系为:CuS<MnS<FeS<ZnS,故B错误;C项,由前面的分析可知,Ksp(MnS)<Ksp(ZnS),向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,先析出MnS沉淀,故C正确;D项,c(Fe2+)=0.1mol/L,加入CuS粉末时,c(S2-)=
Mn2+(aq)+S2-(aq),其溶度积常数为Ksp=c(Mn2+)c(S2-),根据图像可计算Ksp(FeS)=c(Fe2+)c(S2-)=1×10-20,Ksp(CuS)=c(Cu2+)c(S2-)=1×10-35,MnS的曲线在CuS的上方、在FeS下方,因此Ksp(MnS)大于Ksp(CuS)、小于Ksp(FeS),即1.0×10-35<Ksp(MnS)<1×10-20,故A正确;B项,根据图像,Ksp(CuS)最小,其次是Ksp(MnS)、Ksp(FeS),最大的是Ksp(ZnS),同类型物质,在相同条件下,溶度积大的,溶解度也大,因此溶解度关系为:CuS<MnS<FeS<ZnS,故B错误;C项,由前面的分析可知,Ksp(MnS)<Ksp(ZnS),向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,先析出MnS沉淀,故C正确;D项,c(Fe2+)=0.1mol/L,加入CuS粉末时,c(S2-)=![]() =10-17.5mol/L,Q(FeS)=c(Fe2+)c(S2-)=10-18.5>Ksp(FeS),沉淀溶解平衡向生成FeS的方向移动,有FeS沉淀析出,故D正确。
=10-17.5mol/L,Q(FeS)=c(Fe2+)c(S2-)=10-18.5>Ksp(FeS),沉淀溶解平衡向生成FeS的方向移动,有FeS沉淀析出,故D正确。

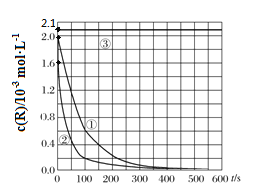
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液