题目内容
10.下图是A、B、C、D、E、F等几种常见有机物之间的转化关系图.其中A是面粉的主要成分;C和E反应能生成F,F具有香味.B与E的实验式相同
在有机物中,凡是具有-CHO结构的物质,具有如下性质:
(1)与新制的氢氧化铜悬浊液反应,产生砖红色的沉淀,
(2)在催化剂的作用下,-CHO被氧气氧化为-COOH,即:
2R-CHO+O2$→_{△}^{催化剂}$2R-COOH
根据根据以上信息及各物质的转化关系完成下列各题:
(1)A的化学式为(C6H10O5)n,B的结构简式为CH2OH(CHOH)4CHO.与B护卫同分异构体的一种物质的名称果糖.
(2)F在稀硫酸中发生水解反应的反应方程式CH3COOCH2CH3+H2O$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH
(3)E与氨水发生的离子方程式CH3COOH+NH3.H2O=CH3COO-+NH4++H2O
E与小苏打溶液反应的化学方程式为CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑
(4)其中能与新制氢氧化铜悬浊液产生砖红色的沉淀的物质有葡萄糖和乙醛(填名称).
(5)写出钠与C的反应方程式2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(6)写出C→D的反应方程式2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O
(7)C+E→F的反应方程式C2H5OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
分析 A是面粉中的主要成分,则A为淀粉,化学式为:(C6H10O5)n;A充分水解得B,B发酵得C、C氧化生成D,D能与新制的Cu(OH)2反应产生砖红色沉淀,则D中含有醛基,所以B为葡萄糖:CH2OH(CHOH)4CHO,葡萄糖发酵生成乙醇,则C为乙醇,乙醇氧化生成乙醛,则D为乙醛,乙醛氧化生成乙酸,则E为乙酸,符合B与E的实验式相同的条件,乙酸与乙醇发生正反应生成F,则F为乙酸乙酯,据此进行解答.
解答 解:A是面粉中的主要成分,则A为淀粉,化学式为:(C6H10O5)n;A充分水解得B发酵得C、C氧化生成D,D能与新制的Cu(OH)2反应产生砖红色沉淀,则D中含有醛基,所以B为葡萄糖:CH2OH(CHOH)4CHO,葡萄糖发酵生成乙醇,则C为乙醇,乙醇氧化生成乙醛,则D为乙醛,乙醛氧化生成乙酸,则E为乙酸,符合B与E的实验式相同的条件,乙酸与乙醇发生正反应生成F,则F为乙酸乙酯,
(1)根据分析可知,A为淀粉,化学式为:(C6H10O5)n;B为葡萄糖,结构简式为:CH2OH(CHOH)4CHO,与葡萄糖互为同分异构体的一种物质为果糖,
故答案为:(C6H10O5)n;CH2OH(CHOH)4CHO;果糖;
(2)F为乙酸乙酯,乙酸乙酯在稀硫酸中发生水解反应生成乙酸和乙醇,反应的化学方程式为:CH3COOCH2CH3+H2O$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH,
故答案为:CH3COOCH2CH3+H2O$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH;
(3)E为乙酸,乙酸与氨水发生的离子方程式为CH3COOH+NH3.H2O=CH3COO-+NH4++H2O,乙酸与碳酸氢钠反应生成乙酸钠、二氧化碳气体和水,反应的化学方程式为:CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑,
故答案为:CH3COOH+NH3.H2O=CH3COO-+NH4++H2O;CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑;
(4)能够与新制Cu(OH)2反应产生砖红色沉淀的物质中一定含有醛基,A到F中含有醛基的为葡萄糖和乙醛,
故答案为:葡萄糖和乙醛;
(5)C为乙醇,钠与C的反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(6)C→D的反应方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
(7)C+E→F的反应方程式为C2H5OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:C2H5OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题为有机推断,侧重考查了常见有机物结构与性质,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,要求学生能够正确书写常见有机反应方程式,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案(1)该电池工作时正极应通入空气(或氧气).
(2)该电池的负极电极反应式为:2H2S+16OH--12e-=2SO32-+10H2O或H2S+8OH--6e-=SO32-+5H2O.
(3)该电池工作时负极区溶液的pH降低(填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物.实验室有下列试剂供选用,请帮助该小组完成实验方案设计.
0.01mol•L-1KMnO4酸性溶液,1mol•L-1HNO3,1mol•L-1H2SO4,1mol•L-1HCl,
0.1mol•L-1Ba(OH)2,0.1mol•L-1BaCl2.
| 实验步骤 | 实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH. | →试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH. |
| ②继续加入足量1mol•L-1HCl 溶液,再加入少量0.1mol•L-1BaCl2溶液,振荡. | →若有白色沉淀产生,则溶液中含有K2SO4. →若无白色沉淀产生,则溶液中没有K2SO4. |
| ③另取少量电解质溶液于试管中,先加1mol•L-1的H2SO4酸化,再滴入2~3滴0.01mol•L-1KMnO4酸性溶液,振荡. | →若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3 |
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
| A. | ①②③④② | B. | ②④①②③ | C. | ④②③①② | D. | ②④②③① |

 +H2
+H2
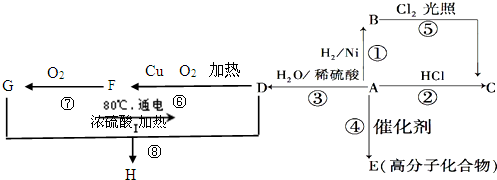
 ;B的结构简式:CH3CH3;
;B的结构简式:CH3CH3;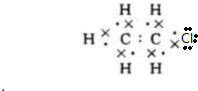 ;D的官能团名称羟基;G官能团的结构简式-COOH.
;D的官能团名称羟基;G官能团的结构简式-COOH.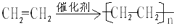 (反应类型加聚反应).
(反应类型加聚反应).