题目内容
5.硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH═2K2SO3+4H2O.(1)该电池工作时正极应通入空气(或氧气).
(2)该电池的负极电极反应式为:2H2S+16OH--12e-=2SO32-+10H2O或H2S+8OH--6e-=SO32-+5H2O.
(3)该电池工作时负极区溶液的pH降低(填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物.实验室有下列试剂供选用,请帮助该小组完成实验方案设计.
0.01mol•L-1KMnO4酸性溶液,1mol•L-1HNO3,1mol•L-1H2SO4,1mol•L-1HCl,
0.1mol•L-1Ba(OH)2,0.1mol•L-1BaCl2.
| 实验步骤 | 实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH. | →试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH. |
| ②继续加入足量1mol•L-1HCl 溶液,再加入少量0.1mol•L-1BaCl2溶液,振荡. | →若有白色沉淀产生,则溶液中含有K2SO4. →若无白色沉淀产生,则溶液中没有K2SO4. |
| ③另取少量电解质溶液于试管中,先加1mol•L-1的H2SO4酸化,再滴入2~3滴0.01mol•L-1KMnO4酸性溶液,振荡. | →若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3 |
分析 用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O,由总方程式可知,反应中S元素化合价升高,H2S被氧化,O元素化合价降低被还原,则通入H2S的一极为负极,通入氧气的一极为正极,负极反应为2H2S+16OH--12e-=2SO32-+10H2O,以此解答(1)(2)(3);
(4)检验是否含有K2SO4,可先加入盐酸除去K2SO3,然后再加氯化钡检验,如生成沉淀,则说明含有K2SO4,K2SO3具有还原性,可用KMnO4溶液检验;
(5)将沉淀在空气中充分加热至恒重,测得固体质量为11.65g,应为BaSO4的质量,可计算出消耗KOH的物质的量,则计算反应后溶液中KOH的物质的量浓度.
解答 解:用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O,由总方程式可知,反应中S元素化合价升高,H2S被氧化,O元素化合价降低被还原,则通入H2S的一极为负极,通入氧气的一极为正极,负极反应为2H2S+16OH--12e-=2SO32-+10H2O,
(1)由以上分析可知正极通入空气(或氧气),故答案为:空气(或氧气);
(2)该电池的负极电极反应式为2H2S+16OH--12e-=2SO32-+10H2O 或H2S+8OH--6e-=SO32-+5H2O,
故答案为:2H2S+16OH--12e-=2SO32-+10H2O 或H2S+8OH--6e-=SO32-+5H2O;
(3)负极消耗OH-,则工作一段时间后溶液pH减小,故答案为:降低;
(4)检验是否含有K2SO4,可先加入足量1mol•L-1 HCl 除去K2SO3,然后再加少量0.1 mol•L-1 BaCl2 检验,如生成沉淀,则说明含有K2SO4,K2SO3具有还原性,可用KMnO4溶液检验,若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3,
故答案为:足量1mol•L-1 HCl;少量0.1 mol•L-1 BaCl2;若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3;
(5)由于BaSO3在空气中加热时转化为BaSO4,将沉淀在空气中充分加热至恒重,测得固体质量为11.65g,应为BaSO4的质量,
n(BaSO4)=$\frac{11.65g}{233g/mol}$=0.0500mol,即n(K2SO4)+n(K2SO3)=0.0500mol,
$n(KOH)=\frac{20.00}{100.00}×\frac{56g}{56g/mol}-0.05×2=0.1000mol$,
$c(KOH)=\frac{0.1000mol}{0.02000L}=5.000mol•{L^{-1}}$,
故答案为:5.000 mol•L-1.
点评 本题考查较为综合,涉及原电池、物质的检验和鉴别等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高频考点,注意把握实验的原理和原电池的工作原理,难度不大.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 42 | B. | 45 | C. | 48 | D. | 60 |
| A. | 0.265mol•L-1 | B. | 0.525mol•L-1 | C. | 0.21mol•L-1 | D. | 0.42mol•L-1 |
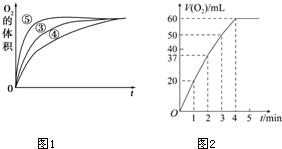 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
| A. | Al3+、Cl-、Ca2+ | B. | Mg2+、SO42-、OH- | C. | Na+、SO32-、H+ | D. | H+、K+、OH- |
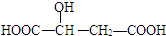 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成生成1molH2 | |
| D. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
 .
.