题目内容
下列热化学方程式书写正确的是
A.2SO2+O2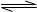 2SO3;ΔH =-196.6kJ/mol 2SO3;ΔH =-196.6kJ/mol |
| B.C(s)+O2(g)=CO2(g);ΔH =393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.5kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l);ΔH =57.3kJ/mol |
C
解析试题分析:A选项为可逆反应,错误。B选项中应为放热反应。错误。C正确。D选项为应为放热反应。
考点:热化学方程式书写

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知热化学方程式(Q1、Q2均为正值):
C(s)+ O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量 |
| D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量 |
下列叙述正确的是 ( )
| A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
| B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| C.用电解水的方法制取大量氢气可以缓解能源不足的问题 |
| D.升高温度活化能降低 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 | C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量为b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1 |
| B.C2H2(g)+5/2 O2(g)=2CO2(g)+H2O(l)ΔH="2b" kJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH="b" kJ·mol-1 |
下列热化学方程式正确的是(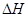 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
下列关于能源和作为能源的物质叙述错误的是
| A.化石能源物质内部蕴涵着大量的能量 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用 |
| D.吸热反应没有利用价值 |
下列有关能量转换的说法正确的是
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列表示甲醇燃烧热的热化学反应方程式是
A.CH3OH(l) +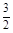 O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1 O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452 kJ·mol-1 |
C.CH3OH(l) +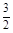 O2(g)=CO2+2H2O△H=-725.8 kJ·mol-1 O2(g)=CO2+2H2O△H=-725.8 kJ·mol-1 |
D.CH3OH(l) +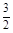 O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ·mol-1 O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ·mol-1 |