��Ŀ����
��֪25�桢101kPa�����£�
��4Al(s)+3O2(g)=2Al2O3(s)����H����2834.9kJ?mol��1
��4Al(s)+2O3(g)=2Al2O3(s)����H����3119.1kJ?mol��1 �ɴ˵ó�����ȷ������
| A����������O2��O3�����ͣ���O2��O3Ϊ���ȷ�Ӧ |
| B����Ӧ�ٿ�ȷ������ȼ������708.7KJ |
| C��O3��O2�ȶ�����O2��O3Ϊ���ȷ�Ӧ |
| D����Ӧ�ڿ�ȷ������ȼ������779.78 kJ?mol��1 |
A
��������������ɷ���ʽ�٨C�ڵã�3O2(g) =2O3(g) ��H=+284.2kJ?mol��1�����Կ�֪������ɳ�����һ�����ȷ�Ӧ�����Ե������ij��������ߣ�A��ȷ��ȼ������ָ�ڳ��³�ѹ�£�1mol������ȫȼ�գ���O2��Ӧ�������ȶ�������ʱ���ų�����������������ȼ����Ӧ���ɢ�ʽȷ������H������2834.9��4��kJ?mol��1 =��708.725 kJ?mol��1 ������D����B��λ����ѡA��
���㣺���⿼����Ƿ�Ӧ�ȵļ��㡢ȼ���ȵĶ���ͱ��

 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д���Ϣ�����ϡ���Դ����Ϊ�¿Ƽ������ġ�����֧���������й۵�������������
| A���ڼ�������������Դʱ��,���ܡ�̫���ܡ����ܽ���Ϊ��Ҫ��Դ |
| B���Ӵ�ú̿�Ŀ����ٶ�,����ú̿ȼ�ϵĹ�Ӧ��,�Ի���ʯ��Σ�� |
| C����������Ϣ��ҵ���й㷺Ӧ��,������µ���Ҫ�����Ƕ������� |
| D�����½ṹ�մɵ����裨Si3N4�����нϸߵ�Ӳ�Ⱥ���ĥ��,�������������������� |
�����Ȼ�ѧ����ʽ��ȷ���ǣ���H�ľ���ֵ����ȷ��( )
| A��C2H5OH(l)��3O2(g)=2CO2(g)��3H2O(g) ; ��H��-1 367.0 kJ��mol��1(ȼ����) |
| B��Ba(OH)2(aq)��2HCl(aq)=BaCl2(aq)��2H2O(l); ��H��-57.3 kJ��mol��1(���) |
| C��S(s)��O2(g)=SO2(g); ��H����269.8 kJ��mol��1(��Ӧ��) |
| D��2NO2=O2��2NO; ��H����116.2 kJ��mol��1(��Ӧ��) |
��֪�Ȼ�ѧ����ʽ(Q1��Q2��Ϊ��ֵ)��
C(s)�� O2(g) =CO(g) ��H����Q1 kJ��mol��1��C(s)��O2(g) =CO2(g) ��H����Q2 kJ��mol��1��
O2(g) =CO(g) ��H����Q1 kJ��mol��1��C(s)��O2(g) =CO2(g) ��H����Q2 kJ��mol��1��
�й�������Ӧ�������������
| A��Q1��Q2 |
| B�������������������ڷ�Ӧ�������� |
| C����1 mol C��Ӧ����1 mol CO����ʱ�ų�Q1 kJ������ |
| D��1 mol CO2������е���������1 mol�ɱ����е����� |
��֪298 Kʱ��H��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1���Ʋ⺬1 mol HCl��ϡ��Һ�뺬1 mol NH3��ϡ��Һ��Ӧ�ų������� (����)
| A������57.3 kJ | B������57.3 kJ |
| C��С��57.3 kJ | D����ȷ�� |
���������Ȼ�ѧ����ʽ��
��1��C(s)��O2(g)=CO2(g)����H1����393.5 kJ��mol��1
��2��H2(g)��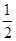 O2(g)=H2O(l) ��H2����285.8 kJ��mol��1
O2(g)=H2O(l) ��H2����285.8 kJ��mol��1
��3��CH3COOH(l)��2O2(g)=2CO2(g)��2H2O(l) ��H3����870.3 kJ��mol��1
���Լ����2C(s)��2H2(g)��O2(g)=CH3COOH(l)�ķ�Ӧ��Ϊ (����)
| A����H����244.1 kJ��mol��1 |
| B����H����488.3 kJ��mol��1 |
| C����H����996.6 kJ��mol��1 |
| D����H����996.6 kJ��mol��1 |
��ҵ����ˮú���ķ�ӦΪ��C(s)��H2O(g)=CO(g)��H2(g) ��H����131��4 kJ/mol�������ж���ȷ���ǣ� ��
| A����Ӧ�������ܺ�С�������������ܺ� |
| B��CO(g)��H2(g)=C(s)��H2O(g) ��H����131��4 kJ/mol |
| C��ˮú����Ӧ�У�����1 mol H2(g)����131��4 kJ���� |
| D��ˮú����Ӧ������1���CO(g)����131��4 kJ���� |
�����Ȼ�ѧ����ʽ��ȷ���ǣ�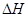 �ľ���ֵ����ȷ��
�ľ���ֵ����ȷ��
| A��C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��g����H=��1367.0 kJ/mol��ȼ���ȣ� |
| B��NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H=+57.3kJ/mol���к��ȣ� |
| C��S��s��+O2��g��=SO2��g����H=��269.8kJ/mol����Ӧ�ȣ� |
| D��2NO2=O2+2NO��H= +116.2kJ/mol����Ӧ�ȣ� |
