题目内容
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
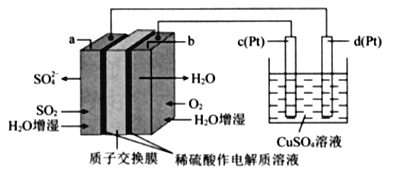
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
【答案】D
【解析】
燃料电池:a端:二氧化硫生成硫酸根离子,硫元素化合价升高失电子所以a为负极,电极反应式SO2+2H2O-4e-=SO42-+4H+;b为正极,电极反应式为O2+4H++4e-=2H2O,总电极反应式2SO2+O2+2H2O=2H2SO4。电解池:c极和电源正极相连为阳极,失电子,电极反应式为4OH—-4e-=2H2O+O2↑,d极与电源负极相连为阴极,得电子,电极反应式为Cu2++2e+=Cu,总电极反应式为2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
A. b为正极,看到质子交换膜确定酸性环境,电极反应式为O2+4H++4e-=2H2O,故不选A;
B.原电池内部阳离子向正极移动,阴离子向负极移动,故不选B;
C.由上面分析可知该燃料电池的总反应为2SO2+O2+2H2O=2H2SO4,故不选C;
D.d极与电源负极相连,为阴极得电子,有铜析出,所以应该是若a电极消耗标况下2.24LSO2,理论上在d极上有6.4g铜析出,故选D;
正确答案:D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目







