题目内容
【题目】二氧化碳的捕集、创新利用是世界能源领域的一个重要战略方向。
(1)用稀氨水喷雾捕集CO2。常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)___________(填“>”“<”或“=”)c(HCO3-);NH4HCO3溶液中物料守恒表达式为________。
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) △H。向1 L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温度、投料比[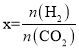 ]的关系如图所示:
]的关系如图所示:
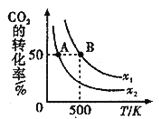
①该反应的△H_______0(填“>”“<“或“=”)。
②图中x1________(填“<”“>”或“=”)x2。
③若图中B点的投料比为2,则500℃时的平衡常数KB=________。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(l) △H=—a kJ·mol-1
反应II:2H2(g)+O2(g)2H2O(1) △H=-b kJ·mol-1
反应III:CH3OH(g)CH3OH(l) △H=-c kJ·mol-1
①CH3OH(l)燃烧热的热化学方程式为_________。
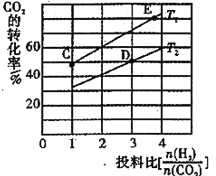
②合成二甲醚的总反应为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H=-130.8 kJ·mol-1。在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=______________。
【答案】> c(NH4+)+ c(NH3H2O)= c(CO32-)+ c(HCO3-)+ c(H2CO3) < > 8 CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)
O2(g)=CO2(g)+2H2O(l) ![]() 0.18molL-1min-1
0.18molL-1min-1
【解析】
(1)根据盐类水解规律,越弱越水解,比较HCO3-与NH4+水解程度的大小关系,进而确定c(NH4+)和c(HCO3-)的大小关系;根据水解和电离情况,结合N元素和C元素守恒可得NH4HCO3溶液中的物料守恒;
(2)①结合图像判断温度对平衡移动的影响;
②根据增加一种反应物的用量,可提高另一反应物的转化率,进行分析;
③结合已知信息列出三段式进行计算;
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,例如C→CO2(g),S→SO2(g),H→H2O(l),先写出表示燃烧热的方程式,再根据盖斯定律和已知的热化学方程式计算反应热;
②根据![]() 计算反应速率。
计算反应速率。
(1)已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,NH3·H2O的电离平衡常数比H2CO3的电离平衡常数大,根据盐类水解规律,越弱越水解,可知HCO3-的水解程度比NH4+的水解程度大,所以c(NH4+)>c(HCO3-);根据N元素和C元素守恒可得NH4HCO3溶液中,物料守恒表达式为c(NH4+)+ c(NH3H2O)= c(CO32-)+ c(HCO3-)+ c(H2CO3),故答案为:>;c(NH4+)+ c(NH3H2O)= c(CO32-)+ c(HCO3-)+ c(H2CO3);
(2)①由图可知,升高温度,CO2的转化率降低,说明升高温度平衡逆向移动,则正反应为放热反应,故该反应的△H<0,故答案为:<;
②相同温度条件下,投料比越大,说明氢气越多,则二氧化碳的转化率越大,根据图可知, x1>x2,故答案为:>;
③根据图中B点的投料比为2,二氧化碳的转化率为50%,容器容积为1L,可列出三段式(单位为mol/L), ,则500℃时的平衡常数
,则500℃时的平衡常数![]() ,故答案为:8
,故答案为:8
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,例如C→CO2(g),S→SO2(g),H→H2O(l),则表示CH3OH(l)燃烧热的化学方程式为CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l),根据盖斯定律可知,可由
O2(g)=CO2(g)+2H2O(l),根据盖斯定律可知,可由![]() 反应II-反应I-反应III得到CH3OH(g)+
反应II-反应I-反应III得到CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l),则
O2(g)=CO2(g)+2H2O(l),则![]() ,故答案为:CH3OH(g)+
,故答案为:CH3OH(g)+O2(g)=CO2(g)+2H2O(l)
![]() ;
;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,此时投料比等于2,由图象可知,5min后反应达到平衡状态时,二氧化碳的转化率为60%,则生成CH3OCH3为6mol×60%×![]() =1.8mol,所以平均反应速率
=1.8mol,所以平均反应速率![]() ;故答案为:0.18molL-1min-1。
;故答案为:0.18molL-1min-1。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
【题目】工业上可用水煤气(CO和H2)合成一系列有机物。
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:_________________________________________________。

(2)已知
① 2H2 (g)+CO(g) ![]() CH3OH (g) ΔH1
CH3OH (g) ΔH1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
③ CO(g)+H2O(g) ![]() CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3
则3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2 (g) ΔH=_________(用ΔH1、 ΔH2、ΔH3列出表达式)。
CH3OCH3(g)+CO2 (g) ΔH=_________(用ΔH1、 ΔH2、ΔH3列出表达式)。
(3)一定条件下的密闭容器中,3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
反应达到平衡后,要提高CO的转化率,可以采取的措施是______(填字母代号)。
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________。
③达到平衡后CH3OH的浓度为_____________。