题目内容
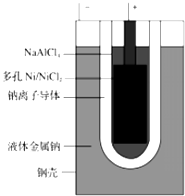
【题目】完成实验Fe与水蒸气反应,如图所示. 
(1)装置A的作用是 .
(2)B中反应的化学方程式: .
(3)碱石灰的作用是 .
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行 , 这一操作的目的是 .
(5)当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是 L.
【答案】
(1)制水蒸气
(2)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(3)干燥氢气
(4)验纯;防止点燃时,氢气因含有氧气而爆炸
(5)8.96
【解析】解:(1)铁与水蒸气反应,则装置A的作用是制水蒸气,所以答案是:制水蒸气;(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2,方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2,所以答案是:3Fe+4H2O(g)
Fe3O4+4H2,所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(3)最后生成的气体为氢气,干燥氢气可以用碱石灰,所以答案是:干燥氢气;(4)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸.所以答案是:验纯;防止点燃时,氢气因含有氧气而爆炸;(5)根据3Fe+4H2O(g)
Fe3O4+4H2;(3)最后生成的气体为氢气,干燥氢气可以用碱石灰,所以答案是:干燥氢气;(4)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸.所以答案是:验纯;防止点燃时,氢气因含有氧气而爆炸;(5)根据3Fe+4H2O(g) ![]() Fe3O4+4H2,则当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是
Fe3O4+4H2,则当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是 ![]() ×
× ![]() ×22.4=8.96L,所以答案是:8.96.
×22.4=8.96L,所以答案是:8.96.

 53随堂测系列答案
53随堂测系列答案【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: 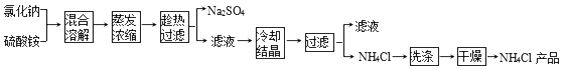
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示: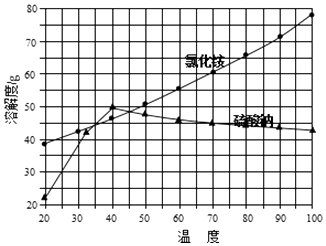
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |