题目内容
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" +28.7" kJ·mol-1 =" +28.7" kJ·mol-1 |
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" -28.7" kJ·mol-1 =" -28.7" kJ·mol-1 |
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" +57.4" kJ·mol-1 =" +57.4" kJ·mol-1 |
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" -57.4" kJ·mol-1 =" -57.4" kJ·mol-1 |
D
试题分析:20.0 g NaOH的物质的量为0.5mol,故1molNaOH反应放出热量为56.4kJ,方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)
 =" -57.4" kJ·mol-1
=" -57.4" kJ·mol-1
练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目

 =____________(写出表达式即可)。
=____________(写出表达式即可)。
 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。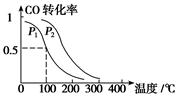

 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: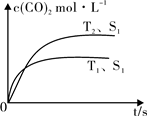
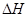 =-867kJ·mol-1
=-867kJ·mol-1 N2O4(g)
N2O4(g) 
 H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 2N (g)
2N (g) 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
 O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。

 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

