��Ŀ����
���ڹ�����ռ����Ҫ��λ��
��1����ҵ�ϳɰ�ʱ���ϳ�����ÿ����1 mol NH3���ų�46.1 kJ��������
�� ��ҵ�ϳɰ����Ȼ�ѧ����ʽ�� ��
�� ��֪��
N2 (g)
 2N (g)
2N (g)H2 (g)
 2H (g)
2H (g)��Ͽ�1 mol N��H�������������_______kJ��
��2���±��ǵ���Ӧ���а�n(N2):n(H2)=1:3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�

�� ����a��Ӧ���¶��� ��
�� ���ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ���� ������ĸ����
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ��ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)=" K(Q)" >K(N)
�� M���Ӧ��H2ת������ ��
 ��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��
��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)��
���ȼ�ϵ�صĸ�����Ӧʽ�� ��
��1����N2(g)+ 3H2(g)  2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O
2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O
 2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O
2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O�����������1���ٺϳ�����ÿ����1mol NH3���ų�46.1kJ�����������Ȼ�ѧ����ʽд������ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ�ų����������Ȼ�ѧ����ʽ��N2��g��+3H2��g��
 2NH3��g������H=-92.2kJ/mol���ڷ�Ӧ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų�������=3��436+945.8-6��N-H������=-92.2��N-H������=391kJ��2���ϳɰ���ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ��Խ�����ڷ�Ӧ�Ľ��У�����a��NH3�����ʵ���������ߣ��䷴Ӧ�¶�Ӧ�����ͣ���aΪ200���A����ʱ�����NH3����ʹƽ�������ƶ�����A��ȷ��B�������ܼӿ췴Ӧ���ʣ������ܸı�ת���ʣ���B����Cƽ�ⳣ��K���¶��йأ������������أ�ͬһ�¶��µ�ƽ�ⳣ����ȣ��ϳɰ���ӦΪ���ȷ�Ӧ�����¶�Խ��ƽ�ⳣ��ԽС����C��ȷ��ѡAC������M��NH3�����ʵ���Ϊ60%��ʣ�����ʵ���Ϊ40%����n(N2):n(H2)=1:3Ͷ�ϣ���ʣ��H2���ʵ���Ϊ30%����ΪN2��g��+3H2��g��
2NH3��g������H=-92.2kJ/mol���ڷ�Ӧ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų�������=3��436+945.8-6��N-H������=-92.2��N-H������=391kJ��2���ϳɰ���ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ��Խ�����ڷ�Ӧ�Ľ��У�����a��NH3�����ʵ���������ߣ��䷴Ӧ�¶�Ӧ�����ͣ���aΪ200���A����ʱ�����NH3����ʹƽ�������ƶ�����A��ȷ��B�������ܼӿ췴Ӧ���ʣ������ܸı�ת���ʣ���B����Cƽ�ⳣ��K���¶��йأ������������أ�ͬһ�¶��µ�ƽ�ⳣ����ȣ��ϳɰ���ӦΪ���ȷ�Ӧ�����¶�Խ��ƽ�ⳣ��ԽС����C��ȷ��ѡAC������M��NH3�����ʵ���Ϊ60%��ʣ�����ʵ���Ϊ40%����n(N2):n(H2)=1:3Ͷ�ϣ���ʣ��H2���ʵ���Ϊ30%����ΪN2��g��+3H2��g�� 2NH3��g������������Ӧ��H2���ʵ���Ϊ90%����M���Ӧ��H2ת������
2NH3��g������������Ӧ��H2���ʵ���Ϊ90%����M���Ӧ��H2ת������ %=75%����3��ԭ����и���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ����Ӧʽ2NH3��6e��+6OH��=N2+6H2O��
%=75%����3��ԭ����и���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ����Ӧʽ2NH3��6e��+6OH��=N2+6H2O��
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ

 O2(g)=H2O��1�� ��H2=-285��8 kJ/mol
O2(g)=H2O��1�� ��H2=-285��8 kJ/mol =" +28.7" kJ��mol-1
=" +28.7" kJ��mol-1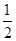 O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2
O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2 [Cu��NH3��3]Ac?CO��aq������H��0��
[Cu��NH3��3]Ac?CO��aq������H��0��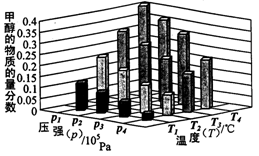
 2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
 2NO(g) ��H����֪�÷�Ӧ�� T ��ʱ��ƽ�ⳣ��K��9.0��
2NO(g) ��H����֪�÷�Ӧ�� T ��ʱ��ƽ�ⳣ��K��9.0��

