题目内容
已知:①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
则CO(g)+H2O(g)=H2(g)+CO2(g)的ΔH为
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1则CO(g)+H2O(g)=H2(g)+CO2(g)的ΔH为
| A.+41.2 kJ?mol-1 | B.-41.2 kJ?mol-1 | C.+82.4kJ?mol-1 | D.-524.8 kJ?mol-1 |
B
试题分析:已知:①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,②H2(g)+
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据盖斯定律可知①-②即得到反应CO(g)+H2O(g)=H2(g)+CO2(g),所以该反应的反应热ΔH=-283.0 kJ·mol-1+241.8 kJ·mol-1=-41.2 kJ?mol-1,所以答案选B。
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据盖斯定律可知①-②即得到反应CO(g)+H2O(g)=H2(g)+CO2(g),所以该反应的反应热ΔH=-283.0 kJ·mol-1+241.8 kJ·mol-1=-41.2 kJ?mol-1,所以答案选B。
练习册系列答案
相关题目
 CO2(g) ΔH1="-393.5" kJ/mol;
CO2(g) ΔH1="-393.5" kJ/mol; O2(g)
O2(g) CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
 =" +28.7" kJ·mol-1
=" +28.7" kJ·mol-1


 ①
①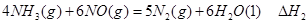 ②
② ③
③ 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式,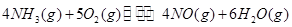
 =
=







 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)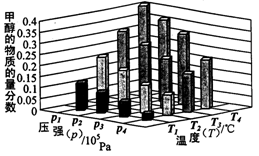
 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。