题目内容
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
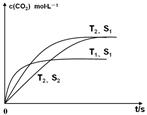
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
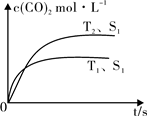
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化 学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
① 煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污
染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)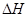 =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g) N2O4(g)
N2O4(g) 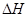 =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。

(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)
 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化 学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
① 煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污
染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)
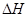 =-867kJ·mol-1
=-867kJ·mol-12NO2(g)
 N2O4(g)
N2O4(g) 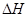 =-56.9kJ·mol-1
=-56.9kJ·mol-1写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。

(1)① (2分) ②<(1分)
(2分) ②<(1分)
③(2分)[起点在原点0处(给1分),达到平衡的时间迟于“T2、S1”曲线的平衡点(给1分)
(2)① CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g)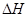 =-810.1 kJ·mol-1(2分)
=-810.1 kJ·mol-1(2分)
②2CO2+2H2O 2HCOOH+O2(2分) a→b (2分)
2HCOOH+O2(2分) a→b (2分)
 (2分) ②<(1分)
(2分) ②<(1分)③(2分)[起点在原点0处(给1分),达到平衡的时间迟于“T2、S1”曲线的平衡点(给1分)

(2)① CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g)
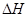 =-810.1 kJ·mol-1(2分)
=-810.1 kJ·mol-1(2分)②2CO2+2H2O
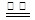 2HCOOH+O2(2分) a→b (2分)
2HCOOH+O2(2分) a→b (2分)试题分析:(1)②反应图像得出TI曲线反应速率快,温度高,其二氧化碳含量低,反应放热;③表面积越大反应速率越快,但催化剂不改变平衡浓度,平衡时二氧化碳浓度相同;(2)①方程式1减方程式2得CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g)
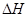 =-810.1 kJ·mol-1;②从电池示意图得出反应物为水和二氧化碳,生成物为甲酸和氧气;水在催化剂a失去电子生成氧气,a为负极,电子流动方向a→b。
=-810.1 kJ·mol-1;②从电池示意图得出反应物为水和二氧化碳,生成物为甲酸和氧气;水在催化剂a失去电子生成氧气,a为负极,电子流动方向a→b。
练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目

 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
 =" +28.7" kJ·mol-1
=" +28.7" kJ·mol-1 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)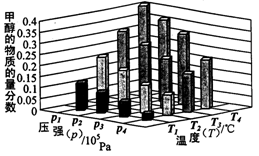


 mol;
mol;

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)