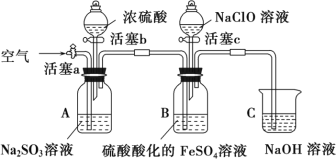
题目内容
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
【答案】 1s22S22p63s23p63d24s2或[Ar] 3d24s2 第4周期第VIII族 正四面体 sp3 产生白色沉淀 [Co (NH3)5SO4]Br 6 ![]() ×1010 或
×1010 或![]() ×103
×103
【解析】(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
(2) 阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为4,属于sp3 杂化,为正四面体构型。
(3)往其溶液中加BaCl2溶液,有白色沉淀,所以该物质为[Co(NH3)5Br]SO4;另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co(NH3)5SO4]Br。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6。
②此晶体属于面心立方晶型,每个晶胞中含有4个Ti原子,根据ρ=m/V进行计算。
(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
(2) Ti(SO4)2、NiSO4中,阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为(6+2)/2=4,则中心原子S原子为sp3 杂化,其空间立体构型是正四面体;正确答案:正四面体;sp3。
(3) 一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液,发生反应Ba2++SO42-=BaSO4↓,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co (NH3)5SO4]Br ;正确答案:产生白色沉淀;[Co (NH3)5SO4]Br 。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6;正确答案:6。
②由晶胞可知,此晶体属于面心立方晶型,而且Ti占据晶胞的顶点和面心,Ni占据晶胞的棱心和体心,则每个晶胞中含有1/4×12+1=4个Ni原子和1/2×6+1/8×8=4个Ti原子,设晶胞晶胞边长apm,则有一个晶胞的质量为(a×10-10)3×d=4×107/NAg,解得a3=![]() ×1030,a=
×1030,a=![]() ×1010 pm 或
×1010 pm 或![]() ×103 pm;正确答案:
×103 pm;正确答案:![]() ×1010 或
×1010 或![]() ×103。
×103。