��Ŀ����
����Ŀ��ijС��ͬѧΪ�Ƚ�����������ClO����SO42-��Fe3+��������ǿ�����������ʵ��(�г���������)��
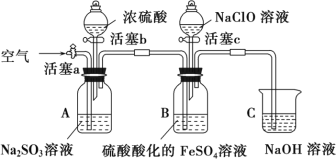
ʵ�鲽�輰�����¼���£�
��������c����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ����ʱ�������رջ��� c��
����ע����ȡ������װ��B�е���Һ���μӼ���KSCN��Һ����Һ��ΪѪ��ɫ��
��������b����װ��A�м�������Ũ����رջ���b��װ��A�в������壬װ��B�������ݣ�һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��
����һ��ʱ�����ע����ȡ������װ�� B �е��ϲ���Һ��
����������a��ͨһ��ʱ�������
��ش��������⣺
��1��������ҩƷǰ����еIJ�����__________________________��
��2��������У�һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ��������ӷ���ʽΪ____________��
��3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯���˶�ʱ������Һ�з�����Ӧ�����ӷ���ʽΪ____________��
��4����������Ϊ����֤����Һ�д��ڵ�Fe2+���벹�������ò�������IJ�����ʵ������_______��
��5����������Ŀ��Ϊ______________��
��6������ʵ�����ɵó���ʵ��Ľ�����_____________��
���𰸡����װ��������![]() SO2��Cl2��2H2O=4H+��SO42����2Cl���μ� K3[Fe(CN)6]��Һ��������ɫ������װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ���������£������ԣ�ClO��>Fe3+>SO42-
SO2��Cl2��2H2O=4H+��SO42����2Cl���μ� K3[Fe(CN)6]��Һ��������ɫ������װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ���������£������ԣ�ClO��>Fe3+>SO42-
��������
��1�������Ʊ������ʵ�ʵ�飬��Ҫ����װ��������������c����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO-����ΪFe3+��ClO-����ԭΪCl-��һ��ʱ���۲쵽װ��B��Һ���Ϸ����ֻ���ɫ����ʱ��˵��Cl-��ClO-����Ϊ��������3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵����ʼFe3+û��Ӧ��������SO2����������ԭ��Ӧ��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-����4��Fe2+��K3[Fe(CN)6]��Һ��������ɫ��������5��SO2��Cl2�ж�����Ⱦ��������6�������������������Դ�����������������Իش���
��1����ʵ���漰��������������Ʊ���ʵ��������ҩƷǰ����еIJ����Ǽ��װ������������2��������У�һ��ʱ���۲쵽װ��B��Һ���Ϸ�����������˵��Cl����ClO������Ϊ��������Ӧ�����ӷ���ʽΪ![]() ����3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵��Fe3+û��Ӧ��������SO2����������ԭ��Ӧ����Ӧ���ӷ���ʽ��SO2��Cl2��2H2O=4H+��SO42-��2Cl-����4����֤����Һ�д���Fe2+�ķ���������ע����ȡ�����ϲ���Һ�еμ� K3[Fe(CN)6]��Һ��������ɫ����������Fe2+����5��������a��ͨһ��ʱ�������Ŀ���ǽ�װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ����6����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO������ΪFe3+��˵��������ClO->Fe3+��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-��������Fe3+>SO42-�����Կɵó���ʵ��Ľ��������������£������ԣ�ClO->Fe3+>SO42-��
����3�������������ʼһ��ʱ����װ��B����Һ����ɫ�������Ա仯��˵��Fe3+û��Ӧ��������SO2����������ԭ��Ӧ����Ӧ���ӷ���ʽ��SO2��Cl2��2H2O=4H+��SO42-��2Cl-����4����֤����Һ�д���Fe2+�ķ���������ע����ȡ�����ϲ���Һ�еμ� K3[Fe(CN)6]��Һ��������ɫ����������Fe2+����5��������a��ͨһ��ʱ�������Ŀ���ǽ�װ���в�����SO2��Cl2����װ��C�У���NaOH��Һ���գ���ֹ��Ⱦ����6����װ��B�μӴ���������Һ����Һ������Ϊ��ɫ��˵��Fe2+��ClO������ΪFe3+��˵��������ClO->Fe3+��һ��ʱ��۲쵽װ��B����Һ��ɫ��dz��ɫ��˵��Fe3+��SO2����ΪSO42-��������Fe3+>SO42-�����Կɵó���ʵ��Ľ��������������£������ԣ�ClO->Fe3+>SO42-��

����Ŀ����ѧ��Ӧ���������������������������
��1��Aѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������200mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 688 | 810 | 860 |
�ٷ�Ӧ��������ʱ����ǣ���0��1��1��2��2��3��3��4��4��5 ��_____ min��ԭ����_____________��
����2��3minʱ����������Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_________��������Һ������䣩
��2��Bѧ��Ҳ��ͬ����ʵ�飬�����ڷ�Ӧ̫�죬�ⲻ�������������취���ͷ�Ӧ���ʣ��������ѡ���������м�������___________�Լ�����Ӧ���ʡ�����д���ţ�
A������ B��HNO3��Һ C��CuSO4��Һ
��3��ij�¶�����10L�ܱ������У�3����̬���ʣ�A��B��C�����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___________
���ڸ������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת����Ϊ____________
��ת����=��ת�������ʵ���/��ʼ���ʵ�������100%��(����������1λС����
