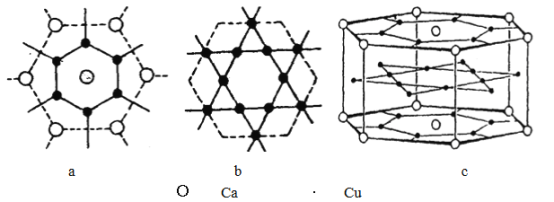
题目内容
【题目】常温下,等体积等pH的盐酸和氯化铵两溶液,下列说法正确的是
A. 两溶液导电能力相同
B. 分别与适量且等量的锌反应,平均反应速率后者大
C. 分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D. 稀释10倍后,盐酸的pH比氯化铵溶液的pH小
【答案】B
【解析】A、盐酸是强酸,完全电离,NH4Cl属于强酸弱碱盐,NH4+水解造成溶液显碱性,因为NH4+水解程度微弱,因此相同pH时,c(NH4Cl)>c(HCl),离子所带电荷越多、离子浓度越大,导电能力越强,即NH4Cl溶液的导电能力强于盐酸,故A错误;B、NH4Cl溶液中存在NH4++H2O![]() NH3·H2O+H+,加入Zn,消耗H+,NH4+还能水解出H+,即反应开始后NH4Cl溶液中c(H+)大于盐酸中c(H+),即后者反应速率快,故B正确;C、盐酸与NaOH反应至中性,溶质为NaCl,NH4Cl与NaOH反应至中性,溶质为NH4Cl和NH3·H2O、NaCl,显然NH4Cl、盐酸消耗NaOH的体积不同,故C错误;D、加水稀释促进NH4+水解,NH4Cl溶液中c(H+)大于盐酸中c(H+),即盐酸的pH比NH4Cl溶液的pH大,故D错误。
NH3·H2O+H+,加入Zn,消耗H+,NH4+还能水解出H+,即反应开始后NH4Cl溶液中c(H+)大于盐酸中c(H+),即后者反应速率快,故B正确;C、盐酸与NaOH反应至中性,溶质为NaCl,NH4Cl与NaOH反应至中性,溶质为NH4Cl和NH3·H2O、NaCl,显然NH4Cl、盐酸消耗NaOH的体积不同,故C错误;D、加水稀释促进NH4+水解,NH4Cl溶液中c(H+)大于盐酸中c(H+),即盐酸的pH比NH4Cl溶液的pH大,故D错误。

练习册系列答案
相关题目