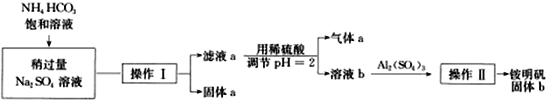
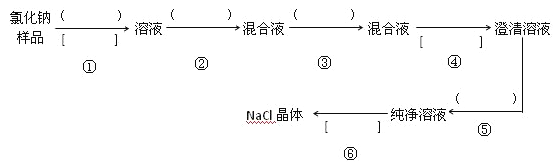
题目内容
【题目】过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
【答案】Ⅰ.(1)氧化性;H2O2+2Fe2++2H+=2Fe3++2H2O
(2)H2O2![]() H++HO2-;HO2-
H++HO2-;HO2-![]() H++O22-;6
H++O22-;6
Ⅱ.(3)锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
(4)0.1800(5)偏高
【解析】
试题分析:Ⅰ.(1)酸性条件下,H2O2氧化Fe2+得到Fe3+和H2O,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;体现了过氧化氢的氧化性;
(2)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2![]() H++HO2- HO2-
H++HO2- HO2-![]() H++O22-;H2O2是一种二元弱酸,Ka1=1.0×10-12,则Ka1=
H++O22-;H2O2是一种二元弱酸,Ka1=1.0×10-12,则Ka1=![]() =1.0×10-12,所以c(H+)=10-6mol/L,即pH=6;
=1.0×10-12,所以c(H+)=10-6mol/L,即pH=6;
Ⅱ.(3)滴定到达终点的现象是,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色;
(4)由于第一次数据误差过大,故舍去;其它三组的平均值为 18.00ml,根据反应2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000molL-1×0.018L,c(H2O2)=![]() =0.1800 mol/L;
=0.1800 mol/L;
(5)滴定前尖嘴中有气泡,导致消耗的标准液偏大,测定结果偏高。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案