题目内容
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
Ⅰ.在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___________________。
Ⅱ.乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g)ΔH=-484kJ/mol
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=________;相同温度下,该反应的化学平衡常数K=____________(用含K1、K2的代数式表示)。
Ⅲ. 甲醇的合成。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
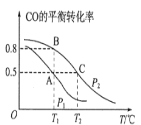
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________。
③下列叙述能说明上述反应能达到化学平衡状态的是______________(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=______,再加入1.0molCO后重新到达平衡,则CO的转化率______(填“增大,不变,减小”)。
【答案】C6H6(l)+ ![]() O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol -406kJ/mol
O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol -406kJ/mol ![]() < KA=KB>KC b 0.02mol/(L·min) 减小
< KA=KB>KC b 0.02mol/(L·min) 减小
【解析】
Ⅰ.燃烧热指的是1mol物质完全燃烧生成稳定的氧化物时放出的热量,据题意可知,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,78g苯燃烧放出78×41.8kJ=3260.4 kJ的热量,据此可以写出C6H6(l)燃烧热的热化学方程式;
Ⅱ.根据盖斯定律进行计算;分别写出①②反应中平衡常数的表达式,二者相除可以得出HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)反应的平衡常数K;
Ⅲ. (1)①CO(g)+2H2(g)CH3OH(g)是气体体积减小的反应,压强增大,平衡右移,CO的平衡转化率增大,据此判定A、B两点对应的压强大小关系;
②根据温度对平衡移动规律的影响进行分析;平衡常数只是温度的函数,据此进行分析;
③根据反应达平衡时,正逆反应速率相等,各组分的浓度不变及由此衍生的其他物理量进行进行;
(2)在P1压强、T1℃时,经5min达到化学平衡,CO的转化率为0.5,据此计算出氢气的变化浓度,据此计算v(H2);可逆反应中,两种物质参加反应,增加该物质的浓度,该物质的转化率减小。
Ⅰ.在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,78g苯燃烧放出78×41.8kJ=3260.4 kJ的热量,表示C6H6(l)燃烧热的热化学方程式为C6H6(l)+![]() O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol;
O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol;
故答案为:C6H6(l)+ ![]() O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol;
O2(g)=6CO2(g)+3H2O(l) △H=-3260.4 kJ/mol;
Ⅱ.已知:①2H2(g)+O2(g) 2H2O(g)ΔH=-484kJ/mol
②OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol
由盖斯定律:①-②,则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH==-484kJ/mol+78kJ/mol= -406kJ/mol;相同温度下,该反应的化学平衡常数K=![]() ;
;
故答案为:-406kJ/mol;![]() ;
;
Ⅲ. (1)①CO(g)+2H2(g)CH3OH(g)是气体体积减小的反应,压强增大,CO的平衡转化率增大,A、B两点对应的压强大小关系是PA<PB;
故答案为:<;
②CO(g)+2H2(g)CH3OH(g),温度升高,CO的平衡转化率减小,说明正反应放热,C点平衡常数小于A点,A、B两点温度相同,平衡常数相同,A、B、C三点的平衡常数KA,KB,KC的大小关系是KA=KB>KC;
故答案为:KA=KB>KC;
③a.只要反应发生就有H2的消耗速率是CH3OH生成速率的2倍,故错误;
b.CH3OH的体积分数不再改变,说明各物质的量不变,反应达平衡状态,故正确;
c.反应前后气体的总质量不变,气体的体积不变,反应过程中混合气体的密度保持不改变,无法判断是否达到平衡,故错误;
d.CO和CH3OH的物质的量之和保持不变,可能平衡也可能未平衡,故错误;
故答案为:b;
(2)在P1压强、T1℃时,经5min达到化学平衡,CO的转化率为0.5,则用氢气表示该反应的化学速率v(H2)=![]() =0.02mol/(L·min),再加入1.0molCO后,加入的CO不可能100%的转化,重新到达平衡,则CO的转化率减小。
=0.02mol/(L·min),再加入1.0molCO后,加入的CO不可能100%的转化,重新到达平衡,则CO的转化率减小。
故答案为:0.02mol/(L·min);减小。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】工业上制取CuCl2的生产流程如下:
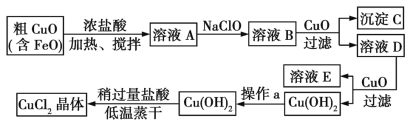
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是_________________。
(2)在溶液B中加入CuO主要涉及的离子反应方程式为________________。
(3)操作a为___________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是___。
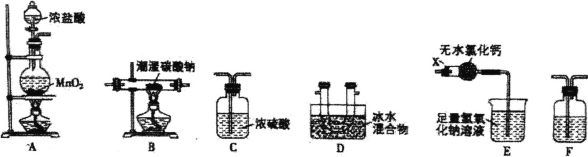
【题目】下表提供的试剂,用如图所示装置,能制备相应气体的是
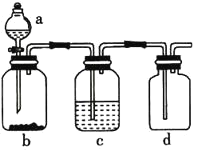
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
A. | 浓盐酸 | 二氧化锰 | 饱和食盐水 | 制备并收集氯气 |
B. | 稀盐酸 | 石灰石 | 浓硫酸 | 制备并收集二氧化碳 |
C. | 稀硫酸 | 粗锌 | 浓硫酸 | 制备并收集氢气 |
D. | 稀硝酸 | 铜粉 | 浓硫酸 | 制备并收集一氧化氮 |
A.AB.BC.CD.D
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________