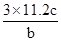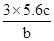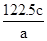题目内容
用NA表示阿伏加德罗常数的值。下列叙述中错误的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |
| B.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA |
| C.标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均为0.2NA |
| D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对 |
A
解析试题分析:A、过氧化钡摩尔质量169g/mol,16.9g就是0.1mol,其中阴离子是过氧根,阳离子是钡离子,0.1mol+0.1mol=0.2mol;B、在1 L 0.1 mol/L碳酸钠溶液中,碳酸根水解,故阴离子总数大于0.1 NA,B正确;C、标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均为0.2NA,C正确;D、常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对,D正确。
考点:阿伏加德罗常数的计算

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
设阿伏加德罗常数为NA, 下列叙述中正确的是
| A.常温常压下, 32克氧气中原子个数为NA |
| B.标准状况下, 1mol H2O的体积为22.4L |
| C.常温常压下, 1molH2的质量为2克 |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
NA表示阿伏加德罗常数的值。下列说法中,正确的是
| A.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 |
| C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA |
| D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.铁与足量稀硝酸反应,1mo1Fe失去电子数为3nA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5nA |
| C.1L1mol?L—1的NH4Cl溶液中有nA个NH4+ |
| D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为nA |
Al63Cu24Fe13是自然界中的一种天然准晶体,将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(盐酸)<n(稀硝酸)<n(烧碱) | B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(烧碱)<n(稀硝酸)<n(盐酸) | D.n(稀硝酸)<n(烧碱)<n(盐酸) |
NA表示表示阿伏伽德罗常数的值,下列说法正确的是
| A.1mol Na2O2粉末中含离子总数为4NA |
| B.22.4LCO2中含有的原子数为3NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.在一定量的稀硝酸中加入56g铁粉且完全溶解,转移的电子一定为3NA |
下图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)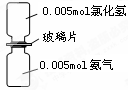
| A.气体反应物的总体积为0.224 L |
| B.产物中所含的N-H键个数为0.015NA |
| C.生成物的物质的量为0.005 mol |
| D.加水溶解后所得溶液中NH4+浓度为0.005 mol.L-1 |