题目内容
NA表示阿伏加德罗常数的值。下列说法中,正确的是
| A.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 |
| C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA |
| D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
C
解析试题分析:A、根据反应式KIO3+6HI=KI+3I2+3H2O可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以每生成3 mol I2转移的电子数为5NA,A不正确;B、由于粗铜中含有锌、铁等金属性强于铜的杂质,它们先于铜放电,所以电解精炼铜时,当电路中转移NA个电子,阳极不一定溶解32 g铜,B不正确;C、由于碘离子的还原性强于亚铁离子,所以氯气首先氧化碘离子,然后再氧化亚铁离子。当有0.1 mol Fe2+被氧化时,说明碘离子易被完全氧化,所以反应中转移电子的物质的量=0.4mol×1+0.1mol×1=0.5mol,C正确;D、氯化铁与沸腾的蒸馏水反应式不能完全进行,所以将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中制得的Fe(OH)3胶粒数小于0.01NA,D不正确,答案选C。
考点:考查阿伏伽德罗常数的有关计算

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B.4.2 g丙烯中所含的共用电子对总数为0.6NA |
| C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
| D.在高温、高压、催化剂的条件下,28gN2和6gH2充分反应,生成NH3的分子数为2NA |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
| B.6.8g液态KHSO4中含有0.1NA个阳离子 |
| C.标况下的NO2气体22.4L,其中含有的氮原子数为NA |
| D.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
下列化学表达方式不正确的是
| A.中子数为20的氯原子:37Cl |
B.S2-的结构示意图: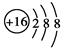 |
C.CCl4的电子式: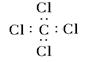 |
D.2-甲基丁烷的结构简式: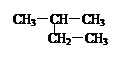 |
用NA表示阿伏加德罗常数的值。下列叙述中错误的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |
| B.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA |
| C.标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均为0.2NA |
| D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对 |
若NA为阿伏加德罗常数的值,下列说法正确的是
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA |
| D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B.标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA |
| C.28 g聚乙烯含有的碳原子数为2NA |
| D.1 mol CH5+所含电子数为8NA |