题目内容
12.氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:(1)NA表示阿伏加德罗常数的数值.69g NO2和N2O4的混合气体中含有3NA个氧原子;2L 0.6mol/LFe(NO3)3溶液中含3.6NA个NO3-.
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式3NF3+5H2O═2NO+HNO3+9HF.
若反应中生成0.15mol HNO3,转移的电子数目为0.3NA或1.806×1023个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为F2、NF3、NO
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有NaNO3(填化学式)
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式NaClO+2NH3$\frac{\underline{\;丙酮\;}}{\;}$N2H4+NaCl+H2O.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=cV结合分子构成计算;
(2)①根据反应物、生成物书写方程式,该反应中N元素化合价由+3价变为+2价、+5价,结合电子、原子守恒分子;根据硝酸和转移电子之间的关系式计算;
②4NH3+3F2=NF3+3NH4F中,F元素的化合价降低,氧化剂的氧化性大于氧化产物的氧化性;
③从质量守恒的角度判断,NF3与H2O反应产生HNO3,HNO3和NaOH反应必生成NaNO3;
(3)次氯酸钠与氨气反应,丙酮作催化剂,根据NaClO氧化NH3可以得到肼来书写方程式.
解答 解:(1)NO2和N2O4的最简式相同,NA表示阿伏加德罗常数的数值,69g NO2和N2O4的混合气体中含有氧原子=$\frac{69g}{46g/mol}$×2×NA/mol=3NA,2L 0.6mol/L Fe(NO3)3溶液中含硝酸根离子=2L×0.6mol/L×3×NA/mol=3.6NA,
故答案为:3;3.6;
(2)①三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,N元素化合价由+3价变为+2价、+5价,由电子、原子守恒可知反应为3NF3+5H2O═2NO+HNO3+9HF,由氧化剂的氧化性大于还原产物的氧化性可知,氧化性为NF3>NO;3NF3+5H2O=9HF+2NO+HNO3中,生成1molHNO3和转移电子2mol,所以若反应中生成0.15mol HNO3,转移的电子数目=0.15mol×2×NA/mol=0.3NA或1.806×1023
故答案为:3NF3+5H2O═2NO+HNO3+9HF;0.3NA或1.806×1023;
②4NH3+3F2=NF3+3NH4F中,F元素的化合价降低,F2为氧化剂,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为F2>NF3,结合①中分析可知,氧化性由强弱的顺序为F2、NF3、NO,
故答案为:F2、NF3、NO;
③NF3与H2O反应产生HNO3,HNO3和NaOH反应必生成NaNO3,故答案为:NaNO3;
(3)制备肼的方法,是以NaClO氧化NH3,反应中还原剂与氧化剂的物质的量之比为2:1,制得肼的稀溶液,反应为NaClO+2NH3$\frac{\underline{\;丙酮\;}}{\;}$N2H4+NaCl+H2O,
故答案为:NaClO+2NH3$\frac{\underline{\;丙酮\;}}{\;}$N2H4+NaCl+H2O.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,注意(1)中二者最简式相同,可以利用其最简式进行计算,为易错点.

 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中的能量变化如图所示(提示:图中能量单位为:千焦(kJ)).则下列叙述不正确的是( )
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中的能量变化如图所示(提示:图中能量单位为:千焦(kJ)).则下列叙述不正确的是( )| A. | E1表示旧键断裂所吸收的能量 | |
| B. | 该反应是放热反应 | |
| C. | 反应中使用催化剂,可使E2-E1的绝对值增大 | |
| D. | 该反应可以用来设计成原电池 |
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | Na2 S203溶液中加入稀硫酸:S2O+2H${\;}_{3}^{2-}$═SO2+S↓+HO2 | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H20 |
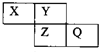 X、Y、Z、Q均为短周期元素,它们在周期表中位置如图所示.若X原子的最外层电子数是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中位置如图所示.若X原子的最外层电子数是内层电子数的2倍.下列说法中,正确的是( )| A. | 气态氢化物稳定性:Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 非金属性比较:X>Y>Z | |
| D. | X与Q的化合物中含有共价键 |
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 分子式为C5H12的烃有三种可能的结构 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 淀粉、纤维素和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
| A. | NA个N2分子和NA个CO分子质量比为1:1 | |
| B. | 1 mol H2O的质量等于6.02×1023个H2O质量的总和 | |
| C. | 在任何条件下1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
| A. | Fe2+浓度增大,绿色变深 | B. | 加盐酸后体积增大,绿色变浅 | ||
| C. | 溶液变棕黄色 | D. | 溶液颜色基本不变 |
| A. | 18gH2O中含有的质子数为10NA | |
| B. | 7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.2NA | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失0NA个电子 |
| A. | 小苏打电离方程式:NaHCO3+H2O?Na++H3O++CO32- | |
| B. | 丙烷分子的球棍模型: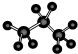 | |
| C. | 氮气化学性质稳定是因为其分子中含有氮氮三键,电子式为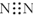 | |
| D. | 核内含有1个质子和1个中子的原子可表示为:${\;}_{1}^{1}$H |