题目内容
2. 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中的能量变化如图所示(提示:图中能量单位为:千焦(kJ)).则下列叙述不正确的是( )
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中的能量变化如图所示(提示:图中能量单位为:千焦(kJ)).则下列叙述不正确的是( )| A. | E1表示旧键断裂所吸收的能量 | |
| B. | 该反应是放热反应 | |
| C. | 反应中使用催化剂,可使E2-E1的绝对值增大 | |
| D. | 该反应可以用来设计成原电池 |
分析 A、图象分析可知E1是断裂化学键吸收的能量;
B、形成化学键放出的能量大于断裂化学键吸收的能量,反应是放热反应;
C、催化剂降低反应的活化能加快反应速率;
D、反应为自发进行的氧化还原反应,可以设计成原电池.
解答 解:A、图象分析可知E1是H2和O2断裂化学键吸收的能量,故A正确;
B、图象分析可知,反应物能量高于生成物,形成化学键放出的能量大于断裂化学键吸收的能量,反应是放热反应,故B正确;
C、催化剂降低反应的活化能加快反应速率,使E2-E1的绝对值减小,故C错误;
D、H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应为自发进行的氧化还原反应,可以设计成原电池,故D正确;
故选C.
点评 本题考查了物质能量变化,化学反应速率影响因素,催化剂的作用原理分析判断,掌握基础是解题关键,题目较简单.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
13.下列说法正确的是( )
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 在一定条件下,1.0 mol的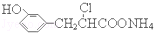 ,最多能与含2.0 mol NaOH的溶液完全反应 ,最多能与含2.0 mol NaOH的溶液完全反应 | |
| C. | 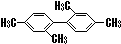 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
10.强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.向1L 0.5 mol•L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为△H1、△H2,则二者的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H2>△H1 | D. | 无法比较 |
17.下列关于实验安全的叙述中错误的是( )
| A. | 实验时手掌不小心沾上苯酚,立即用65°以上的热水清洗 | |
| B. | 汞洒落后,应立即撒上硫磺,并打开墻下面的排气扇 | |
| C. | 万一眼中溅进酸或碱溶液,应立即用水冲洗(切忌用手揉),然后请医生处理 | |
| D. | 少量浓硫酸溅到皮肤上,立即用大量水冲洗 |
7.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
14.下列变化一定会影响化学平衡的是( )
| A. | 浓度 | B. | 催化剂 | C. | 压强 | D. | 温度 |
11.下列化学反应中,不属于氧化还原反应( )
| A. | 2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | Cl2+H2O═HCl+HClO |