题目内容
4.浅绿色的硝酸亚铁溶液存在如下平衡 Fe2++2H2O?Fe(OH)2+2H+在溶液中加入盐酸后.溶液变( )| A. | Fe2+浓度增大,绿色变深 | B. | 加盐酸后体积增大,绿色变浅 | ||
| C. | 溶液变棕黄色 | D. | 溶液颜色基本不变 |
分析 根据离子浓度对盐类水解平衡的影响分析解答,注意二价铁离子有还原性,硝酸有强氧化性,亚铁离子和硝酸能发生氧化还原反应生成三价铁离子.
解答 解:硝酸亚铁溶液中含有亚铁离子和硝酸根离子,且存在水解平衡,向溶液中加入盐酸,氢离子浓度增大,水解平衡向逆反应方向移动;溶液中含有硝酸根离子和氢离子,所以含有硝酸,硝酸具有强氧化性能把亚铁离子氧化成铁离子,铁离子显黄色,
故选C.
点评 本题考查了影响盐类水解,注意酸性条件下,硝酸根离子和亚铁离子能发生氧化还原反应而使亚铁离子生成铁离子,属于易错题.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
14.下列变化一定会影响化学平衡的是( )
| A. | 浓度 | B. | 催化剂 | C. | 压强 | D. | 温度 |
19.20g某元素中含有0.5NA个原子,则该元素的相对原子质量为( )
| A. | 2 | B. | 4 | C. | 40 | D. | 20 |
13.已知298.15K时,可逆反应:Pb2+(aq)+Sn(s)?Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10mol•L-1,则此时反应进行的方向是( )
| A. | 向正反应方向进行 | B. | 向逆反应方向进行 | ||
| C. | 处于平衡状态 | D. | 无法判断 |
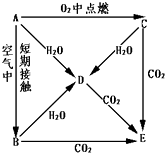 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.