题目内容
18.如图转化关系中的框中是一种反应物或生成物(溶剂、反应的水或生成的水及与沉淀物同时生成的物质均已略去),其中A、N焰色为黄色,I是常见的挥发性强酸.填下空.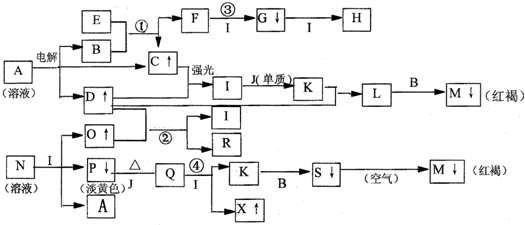
(1)写出化学式:HAlCl3KFeCl2NNa2S2O3.
(2)写出离子方程式:①2Al+2OH-+2H2O=2AlO2-+3H2↑②SO2+Cl2+2H2O═SO42-+4H++2Cl- ③AlO2-+H++H2O═Al(OH)3↓④FeS+2H+=H2S↑+Fe2+.
(3)单质P的晶体类型为分子晶体.
分析 A、N焰色为黄色,则A、N含有钠元素,A溶液电解得C、D气体,C、D气体在光照条件下反应生成I,I是常见的挥发性强酸,则A为NaCl,B为NaOH,I为HCl,C、D为H2和Cl2,N能和盐酸反应生成淡黄色沉淀P、气体O及氯化钠,可知N为Na2S2O3,O为SO2,P为S,SO2与D能反应,则D为Cl2,所以C为H2,二氧化硫与氯气反应生成氯化氢和硫酸,所以R为H2SO4,E与B反应生成氢气和F,且F能连续与盐酸反应,则E为Al,F为NaAlO2,G为Al(OH)3,H为AlCl3,M为红褐色沉淀,则M为Fe(OH)3,可以推得L为FeCl3,所以K为FeCl2,J为Fe,沉淀S在空气中生成氧化铁,则S为Fe(OH)2,硫与铁反应生成Q为FeS,与盐酸反应生成X为H2S,据此答题.
解答 解:A、N焰色为黄色,则A、N含有钠元素,A溶液电解得C、D气体,C、D气体在光照条件下反应生成I,I是常见的挥发性强酸,则A为NaCl,B为NaOH,I为HCl,C、D为H2和Cl2,N能和盐酸反应生成淡黄色沉淀P、气体O及氯化钠,可知N为Na2S2O3,O为SO2,P为S,SO2与D能反应,则D为Cl2,所以C为H2,二氧化硫与氯气反应生成氯化氢和硫酸,所以R为H2SO4,E与B反应生成氢气和F,且F能连续与盐酸反应,则E为Al,F为NaAlO2,G为Al(OH)3,H为AlCl3,M为红褐色沉淀,则M为Fe(OH)3,可以推得L为FeCl3,所以K为FeCl2,J为Fe,沉淀S在空气中生成氧化铁,则S为Fe(OH)2,硫与铁反应生成Q为FeS,与盐酸反应生成X为H2S,
(1)根据上面的分析可知,H为AlCl3,K为FeCl2,N为Na2S2O3,
故答案为:AlCl3;FeCl2;Na2S2O3;
(2)①的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,②的离子方程式为SO2+Cl2+2H2O═SO42-+4H++2Cl-,③的离子方程式为AlO2-+H++H2O═Al(OH)3↓,④的离子方程式为FeS+2H+=H2S↑+Fe2+,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;SO2+Cl2+2H2O═SO42-+4H++2Cl-;AlO2-+H++H2O═Al(OH)3↓;FeS+2H+=H2S↑+Fe2+;
(3)P为S,单质P的晶体类型为分子晶体,故答案为:分子晶体.
点评 本题考查无机物的推断,为高频考点,侧重元素化合物知识的综合考查,把握Al及其化合物、Cl及其化合物、铁及其化合物转化为解答的关键,物质的颜色和反应的特征为解答本题的突破口,题目难度中等.

| A. | 纯净的二氧化硅具有良好光学性能,可用于制作光导纤维 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | BaCO3难溶于水,可用作胃透视检查时的钡餐 | |
| D. | NaHCO3受热易分解,可用作焙制糕点的膨松剂 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | 标准状况下,22.4L四氯化碳CCl4含有的分子数为NA | |
| B. | 常温常压下,18g水含有的分子数为 NA | |
| C. | 1molCu和足量浓硝酸反应产生NO分子数为NA | |
| D. | 1.0mol•L-1 Na2CO3溶液中含有CO32-数为 NA |
| A. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| B. | 在硫酸亚铁溶液中,加入铁粉以防止氧化变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集氯气 |
| A. | X和Y能够形成能使澄清石灰水变浑浊的常见气体 | |
| B. | X、Y和Z能形成化学式为Z2XY3的化合物,该物质水溶液呈碱性 | |
| C. | X、Y、Z的原子半径:Z>X>Y | |
| D. | Y和Z只能形成一种化合物 |