题目内容
【题目】标准状况下VL氨气溶解在lL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数Ψ,物质的量浓度为cmol/L则下列关系中不正确的是
A. Ψ=17c/(1000p) B. Ψ=17V/(17V+22400)
C. p=17V/(22.4+22.4V)/(17V+22400) D. c=1000Vp/(17V+22400)
【答案】C
【解析】A.根据c=1000ρw/M可知,该氨水质量分数Ψ=17c/(1000p) ,故A正确;
B.标准状况下VL氨气溶解在1L水中,所得溶液的质量为V/22.4×17+1L×1000×1g·mL-1=(V/22.4×17+1000)g,Ψ=17V/22.4÷((V/22.4×17+1000)=17V/(17V+22400),故B正确;
C.标准状况下VL氨气溶解在1L水中,所得溶液的质量为V/22.4×17+1L×1000×1g·mL-1=(V/22.4×17+1000)g,溶液体积为![]() ,,所以溶液的密度为
,,所以溶液的密度为![]() ,,故C错误;
,,故C错误;
D.c=1000Ψρ/Mr,由于Ψ=17V/22.4÷((V/22.4×17+1000),代入公式即得c=1000Vp/(17V+22400),故D正确;

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去);
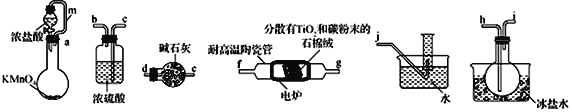
相关信息如下表所示:
熔点/℃ | 沸点/℃ | 密度/(g cm-3) | 水溶性 | |
TiCl4 | -25 | 136 | 1.5 | 易水解,能溶于有机溶剂 |
CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为_____________(填仪器接口字母)
(2)根据完整的实验装置进行实验,实验步骤如下:检査装置气密性后,装入药品;_____________
(按正确的顺序填入下列操作的字母)。
A.关闭分液漏斗活塞 B.停止加热,充分冷却
C.打开分液漏斗活塞 D.加热装置D中陶瓷管
实验时,当观察到______________时,开始进行步骤D。
(3)装置A中导管m的作用为_______________________。
(4)装置C的作用为 ___________________________________________。
(5)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________________________。
(6)设计实验证明装置 F中收集到的液体中含有TiCl4:______________________________________________。
(7)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_________________。
