题目内容
【题目】Ⅰ.羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的键角关系是PH3___NH3(填“>”或“<”),PO43-离子空间构型是___。
(3)现已合成含钙的全氮阴离子盐,其中阴离子N5-为平面正五边形结构,N原子的杂化类型是___。
(4)碳酸钙的分解温度远高于碳酸镁,其原因是___。
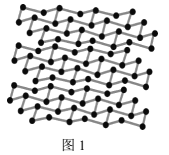
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图1所示:其中最小的环为6元环,每个环平均含有___个P原子。
Ⅱ.钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图2所示。
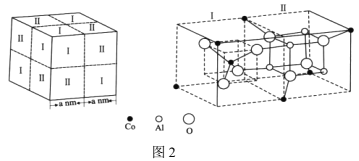
(6)基态Co原子的价电子排布式为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___ g·cm-3(列计算式)。
【答案】O>P>H>Ca 小于 正四面体 sp2 镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此碳酸镁的热分解温度低 2 3d74s2 CoAl2O4 ![]()
【解析】
(1)同周期从左到右元素的电负性变大,同主族从上到下电负性变小,Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是O>P>H>Ca;
(2)NH3和PH3的空间构型都是三角锥型,但是,NH中N-H键的键长比PH中P-H键的键长要短,所以在NH3中,成键电子对更靠近,排斥力更大,以致键角更大。而PH3中成键电子对之间的斥力减小,孤对电子对成键电子的斥力使H-P-H键角更小。PH3与同主族元素N形成的氢化物的键角关系是PH3<NH3;PO43-中心原子为P,其中σ键电子对数为4,中心原子孤电子对数=![]() ×(5+3-4×2)=0,PO43-中心原子价层电子对对数为4+0=4,P原子sp3杂化,PO43-离子空间构型是正四面体。
×(5+3-4×2)=0,PO43-中心原子价层电子对对数为4+0=4,P原子sp3杂化,PO43-离子空间构型是正四面体。
故答案为:<;正四面体;
(3)含钙的全氮阴离子盐,阴离子N5-为平面正五边形结构,中心原子N,其中σ键电子对数为2,中心原子存在大π键,所以N原子的杂化类型是sp2。
故答案为:sp2;
(4)由于镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此,碳酸镁的热分解温度低。
(5)黑磷与石墨烯类似,其中最小的环为6元环,每个环平均含有6×![]() =2个P原子。
=2个P原子。
故答案为:2
(6)基态Co原子的价电子排布式为3d74s2;I、II各一个小正方体为一个晶胞,该晶胞中Co原子个数=(4×![]() +2×
+2×![]() +1)×4=8、Al原子个数=4×4=16、O原子个数=8×4=32,Co、Al、O原子个数之比=8:16:32=1:2:4,化学式为CoAl2O4;该晶胞体积=(2a×10-7 cm)3,钴蓝晶体的密度=
+1)×4=8、Al原子个数=4×4=16、O原子个数=8×4=32,Co、Al、O原子个数之比=8:16:32=1:2:4,化学式为CoAl2O4;该晶胞体积=(2a×10-7 cm)3,钴蓝晶体的密度=![]() =
=![]() g·cm-3(列计算式)。
g·cm-3(列计算式)。
故答案为:3d74s2;CoAl2O4;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案